Компьютерная томография
Выполнение КТ головного мозга в первые часы от развития инсульта необходимо проводить для исключения внутричерепного кровоизлияния (рисунок 1), наличие которого является абсолютным противопоказанием к проведению тромболитической терапии.
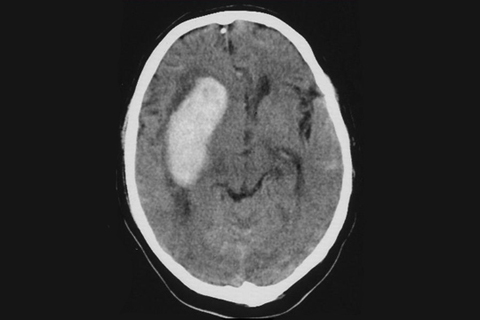
Рисунок 1. КТ головного мозга у больного геморрагическим инсультом
Согласно современным рекомендациям, нативная КТ должна выполняться в течение первых 20 минут после прибытия пациента в стационар (правило «золотого часа» изложено разделе «Специфическая терапия»). Отсутствие в острейшем периоде изменений по данным КТ головного мозга свидетельствует только о том, что исключен геморрагический тип инсульта.
Динамика очага ишемии при проведении КТ головного мозга в течение первых 48 часов от развития симптоматики представлена на рисунках 2а, 2б.
Рисунок 2а. КТ головного мозга больного ишемическим инсультом спустя 3 часа от дебюта инсульта (отсутствуют изменения в мозговой ткани)
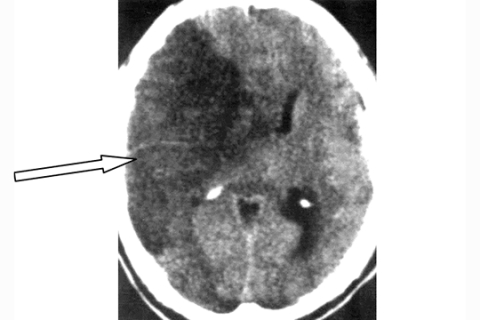
Рисунок 2б. КТ головного мозга этого же больного спустя 48 часов от дебюта инсульта (обширный гиподенсный очаг со смещением срединных структур, свидетельствующий об ишемическом типе инсульта)
Однако существуют ранние КТ-признаки ишемического инсульта. К таковым относятся:
- Снижение рентгеновской плотности одной трети и более бассейна средней мозговой артерии.
- Гиподенсивность базальных ядер.
- Сглаженность корковых борозд.
- Утрата разграничения серого/белого вещества вдоль инсулярной области (признак «инсулярной ленты»), исчезновение Сильвиевой щели.
- Усиление КТ-сигнала от средней мозговой артерии и других артерий (признак « или «симптом точки»).
- Потеря дифференцировки серого и белого вещества в подкорковой области (рисунок 3б).
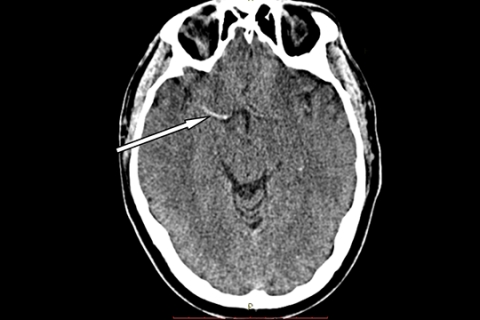
Рисунок 3а. КТ головного мозга больного ишемическим инсультом в острейшем периоде инсульта. Стрелкой указана гиперденсивная правая средняя мозговая артерия
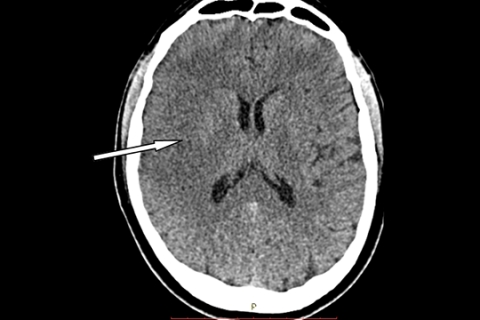
Рисунок 3б. КТ головного мозга больного ишемическим инсультом спустя 5 часов от дебюта инсульта. Стрелкой указан участок снижения дифференцировки на белое и серое вещество в правом полушарии. В этой зоне межгирусные пространства несколько стерты
Наличие ранних КТ-признаков церебрального ишемического повреждения свидетельствует об обширном повреждении вещества мозговой ткани и ассоциируется с неблагоприятными функциональными исходами.
Оценка распространенности очага инфаркта головного мозга
Распространенность ишемического повреждения вещества головного мозга в бассейне СМА можно оценить по шкале ASPECTS. Бассейн СМА делится на десять областей, которые оцениваются на аксиальных КТ-срезах: хвостатое ядро, островок, чечевицеобразное ядро, внутреннюю капсулу и шесть других корковых областей (»M1» — «M6») (рисунок 4). Оценка складывается путём вычитания из 10 по 1 баллу за выявление ишемической гиподенсивности в каждой области. Таким образом, в случае интактного бассейна СМА будет выставлена оценка «10», а при полном вовлечении бассейна в область инфаркта — оценка «0».
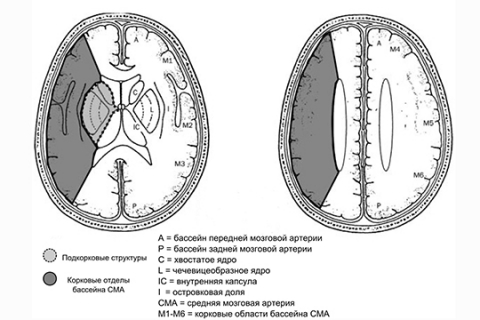
Рисунок 4. Шкала ASPECTS
Перфузионная компьютерная томография
Метод основан на изменении рентгеновской плотности ткани во время прохождения внутривенно введенного контрастного вещества (КВ). При перфузионной КТ (ПКТ) прохождение КВ по церебральной сети капилляров отслеживается на серии КТ–срезов. На основании данных об изменении рентгеновской плотности элементов изображения по мере прохождения КВ строится график зависимости плотности (т. е. изменения концентрации КВ в каком–либо элементе среза) от времени (time–density curve, TDC). Сканирование обычно проводится на уровне глубинных структур мозга и базальных ганглиев с захватом супратенториальных участков, кровоснабжаемых передней, средней и задней мозговыми артериями. Анализируются следующие параметры:
Объем церебрального кровотока (cerebral blood volume, CBV) – общий объем крови в выбранном участке мозговой ткани. Это понятие включает кровь как в капиллярах, так и в более крупных сосудах – артериях, артериолах, венулах и венах. Данный показатель измеряется в миллилитрах крови на 100 г мозгового вещества (мл/100 г);
Скорость церебрального кровотока (cerebral blood flow, CBF) – скорость прохождения определенного объема крови через заданный объем ткани мозга за единицу времени. CBF измеряется в миллилитрах крови на 100 г мозгового вещества в минуту (мл/100 г x мин. );
Среднее время прохождения (mean transit time, MTT) – среднее время, за которое кровь проходит по сосудистому руслу выбранного участка мозговой ткани, измеряется в секундах (с). Согласно принципу центрального объема, эти параметры связаны соотношением CBV = CBF x MTT.
При проведении ПКТ церебральная перфузия оценивается по картам, построенным для каждого из параметров, а также по их абсолютным и относительным значениям в соответствующих областях головного мозга. Помимо CBF, CBV и МТТ, может также вычисляться время до достижения максимальной (пиковой) концентрации контрастного вещества (time to peak, TTP). Исследователь может выделить на срезе несколько областей интереса (ROI, region of interest), для которых рассчитываются средние значения показателей церебральной перфузии, и строится график «время–плотность».
Нормальные значения перфузионных параметров вещества ГМ представлены в таблице 1.
Таблица 1. Нормальные значения перфузионных параметров серого и белого вещества головного мозга по данным ПКТ
| Область | CBF, мл/100г х мин | CBV, мл/100г | МТТ, с |
|---|---|---|---|
| Серое вещество | 60 | 4 | 4 |
| Белое вещество | 25 | 2 | 4,8 |
При нарушениях кровоснабжения головного мозга соотношение параметров перфузии закономерно изменяется, таблица 2.
Таблица 2. Изменения перфузионных параметров при различных стадиях нарушения мозгового кровоснабжения ткани головного мозга
| Стадия | ЦПД | CBF | CBV | МТТ |
|---|---|---|---|---|
| Сохранная ауторегуляция | ↓ | N | ↑ | ↑ |
| Олигемия | ↓↓ | ↓ | ↑ | ↑ |
| Пенумбра | ↓↓↓ | ↓↓ | ↑/N | ↑↑ |
| Необратимое поражение (ядро инфаркта) | ↓↓↓↓ | ↓↓↓ | ↓ | ↑↑ |
N-нормальные значения, ↓ — снижение, ↑ — повышение
Небольшое снижение церебрального перфузионного давления (ЦПД) приводит к компенсаторному расширению церебральных артериол и снижению сосудистого сопротивления. Соответственно, измеренное при помощи ПКТ значение CBF в этой ситуации будет оставаться нормальным, а МТТ и CBV окажутся повышенными. В случае умеренного снижения ЦПД вазодилатация обеспечивает поддержание кровотока на пределе компенсаторных возможностей. Признаком этого служит еще большее удлинение МТТ и увеличение CBV. При дальнейшем снижении ЦПД механизмы ауторегуляции перестают функционировать, расширение церебральных сосудов уже не в состоянии обеспечить достаточную перфузию, что приводит к снижению и CBF, и CBV. Чем более выражено снижение кровотока, тем меньше времени требуется для развития необратимых изменений. Как правило, зона инфаркта окружена потенциально жизнеспособной тканью, находящейся в условиях ишемии – пенумброй. «Инструментально выявленная пенумбра» — это участок ткани, в котором отмечается различие между площадью зон с измененными CBV и CBF. При этом зона, в которой снижены CBV и CBF, представляет собой ядро инфаркта, а зона со сниженным CBF и нормальным CBV (т. н. CBF–CBV несоответствие) – окружающий ядро инфаркта участок ткани со сниженной перфузией и нарушенным функционированием, но еще сохраняющий жизнеспособность.
В случае тяжелого ишемического поражения зоны измененного CBV и CBF практически совпадают, что говорит о необратимом повреждении мозговой ткани и об отсутствии необходимости экстренной реперфузии. Длительность существования ишемической пенумбры зависит как от времени, прошедшего от момента нарушения кровоснабжения мозговой ткани, так и от индивидуальных особенностей пациента. В первые 3 часа от начала заболевания пенумбра обнаруживается у 90–100% пациентов, однако в 75–80% случаев она выявляется и на протяжении первых 6 часов. Это свидетельствует о том, что использование КТ-перфузии с целью верификации зоны пенумбры целесообразно для отбора пациентов, которым показано проведение тромболитической терапии вне зависимости от времени, прошедшего с момента развития ИИ. Данные ПКТ (КТ) пациента с сохраненной пенумброй в острейшем периоде ишемического инсульта до и после тромболитической терапии представлены на рисунках 5а и 5б.
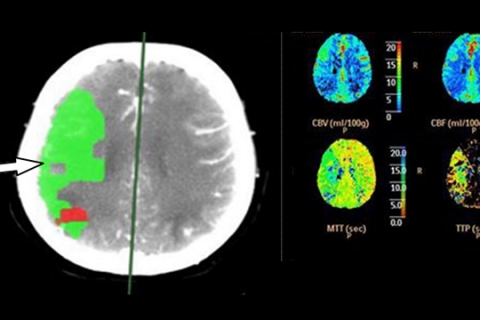
Рисунок 5а. Перфузионная КТ головного мозга больного в острейшем периоде ишемического инсульта (до тромболизиса). Стрелкой указана зона пенубры
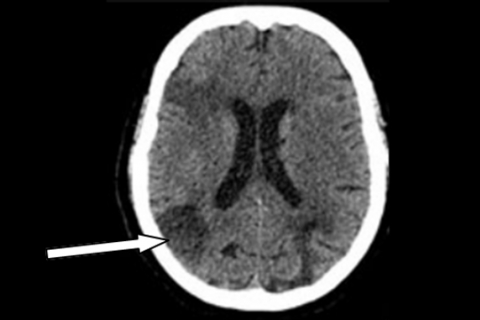
Рисунок 5б. Нативная КТ головного мозга у больного ишемическим инсультом спустя 24 часа после тромболитической терапии
Необходимо подчеркнуть, что выявление зон потенциально жизнеспособной и необратимо поврежденной ткани при формировании ишемического очага с помощью ПКТ должно быть основано не только на определении мозгового кровотока (CBF), но и на оценке соотношения между кровотоком, объемом крови и длительностью прохождения крови в поврежденной области, то есть всеми регистрируемыми параметрами перфузии.
Магнитно-резонансная томография
МРТ является более чувствительным инструментом для верификации острого фокального ишемического повреждения вещества головного мозга, чем КТ. Протоколы МРТ головного мозга включают T1 — и T2 — последовательности, FLAIR, диффузионно-взвешенные изображения (DWI) с построением измеряемого коэффициента диффузии (ADC), перфузионно-взвешенные (PWI) изображения. Для исключения внутримозговых микрокровоизлияний предпочтительно включать в протокол T2* — (режим, позволяющий выявить мелкие, скрытые кровоизлияния, визуализируя отложения гемосидерина) или SWI — (изображение, взвешенное по магнитной восприимчивости) последовательности. Данные МРТ головного мозга представлены на рисунках 6а и 6б.
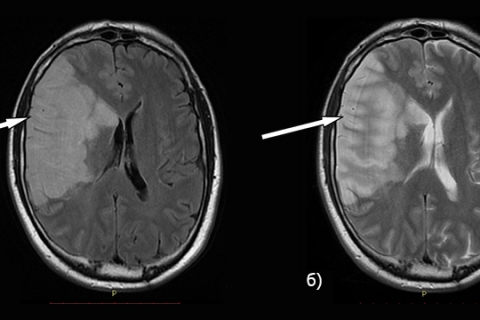
Рисунок 6. МРТ головного мозга в T2 Flair (а) и Т2 (б) режимах у больного ишемическим инсультом на 3 сутки после дебюта инсульта. Стрелкой указана обширная зона ишемических изменений в правой височно-лобно-теменной области, в головке хвостатого ядра, внутренней капсуле справа с деформацией правого бокового желудочка, смещение серединных структур на 6 мм
Однако высокая стоимость МР-диагностики, более низкая по сравнению с КТ доступность аппаратуры, ограничения проведения у пациентов в критических состояния и с психомоторным возбуждением, невозможность выполнения у пациентов с металлическими конструкциями в теле, ограничивают использование данного метода. Противопоказания к проведению данной диагностической процедуры делятся на абсолютные и относительные.
Относительными противопоказаниями к проведению МРТ являются:
- беременность (первый триместр);
- инсулиновые насосы;
- искусственные клапаны сердца;
- гемостатические клипсы;
- стимуляторы нервной системы;
- клаустрофобия (при обследовании в туннельных томографах);
- татуировки на теле, выполненные металсодержащими красящими веществами.
Абсолютные противопоказания к МРТ:
- наличие МР-несовместимого кардиостимулятора;
- установленный аппарат Илизарова;
- большие металлические имплантаты, ферромагнитные осколки;
- имплантат среднего уха;
- внутричерепные кровоостанавливающие клипсы из металла.
Рутинное использование МРТ головного мозга у всех пациентов с острым ишемическим инсультом не является экономически эффективным и не рекомендуется для первоначальной диагностики или перед решением вопроса о дальнейшей тактике лечения.
Диффузионно-взвешенная магнитно-резонансная томография
Этот метод основан на возможности МРТ выявлять сигнал, связанный с движением молекул воды (Броуновское движение) под действием двух близких по частоте импульсных последовательностей, что позволяет верифицировать изменения, вызванные ишемией, уже через 3 — 30 минут после их развития, когда результаты обычного МРТ-исследования и КТ головного мозга могут оставаться нормальными. Острая церебральная ишемия приводит к деполяризации мембран, изменениям мембранной проницаемости, изменениям в ионном обмене и поступлению воды в клетки. Набухание клеток влечет за собой компрессию экстрацеллюлярного пространства, ограничение диффузии экстрацеллюлярной воды и, возможно, ограничение диффузии интрацеллюлярной воды вследствие изменений органелл. Эти изменения приводят к повышению сигнала на DWI (рисунок 7) и низким значениям измеряемого коэффициента диффузии (ADC). Измеряемый коэффициент диффузии (Apparent Diffusion Coefficient — ADC) — количественная характеристика диффузионных процессов в тканях. Это усредненное значение сложных диффузионных процессов, протекающих в биологических структурах, то есть количественная характеристика диффузии воды во внутриклечном и внеклеточном пространствах с учетом разнообразных источников внутривоксельных несогласованных и разнонаправленных движений, таких как внутрисосудистый кровоток в мелких сосудах, движение ликвора в желудочках и субарахноидальных пространствах и т. д. Границы показателей ADC в норме известны, у взрослых людей они находятся в пределах от 0,590×10-3mm2/s до 0,950×10-3 mm2/s.
Последующий лизис, сморщивание клеток и разрежение ткани ведут к увеличению внеклеточного пространства и содержания воды с одновременным снижением интенсивности сигнала на DWI и повышением значений ADC. Данные МРТ головного мозга в диффузионно-взвешенном режиме представлены на рисунке 7.
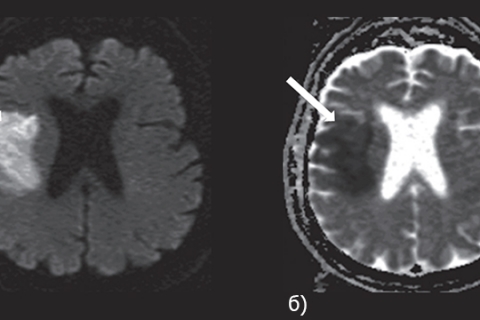
Рисунок 7. МРТ головного мозга в DWI — (а) и ADC — (б) режимах. Стрелкой указана зона ишемических изменений в правом полушарии головного мозга
Ограничение диффузии области инфаркта является транзиторным и продолжается от одной до двух недель. Впоследствии оно перестаёт отмечаться, проходя через фазу псевдонормализации. Инфаркт в хронической фазе не имеет яркой окраски на DWI.
МРТ в режиме DWI обладает высокой чувствительностью и специфичностью в диагностике ишемического инсульта, однако, исследования показали, что небольшие ишемические очаги в стволе мозга при использовании данной методики, могут остаться не обнаруженными. Следует помнить, что проведение мульмодальной КТ и МРТ головного, включающая перфузионную визуализацию, не должны быть причиной задержки выполнения системного тромболизиса.
Перфузионно-взвешенная магнитно-резонансная томография
Основная цель проведения перфузионно-взвешенной (PWI) МРТ – оценка церебральной гемодинамики. Самой распространенной техникой проведения процедуры является болюсно-контрастное отслеживание. Визуализация производится на основе мониторинга прохождения контрастного вещества (препараты гадолиния) через ткань головного мозга. Интенсивность сигнала снижается по мере прохождения контраста через зону инфаркта и возвращается к норме при выходе из этой области. На основе таких показателей, как CBF (скорость церебрального кровотока, cerebral blood flow), CBV (объем церебрального кровотока (cerebral blood volume, MTT (среднее время прохождения mean transit time), TTP (время до достижения максимальной (пиковой) концентрации контрастного вещества, time to peak) составляются перфузионные карты (характеристики приведенных показателей подробно освещены ранее в разделе «Перфузионная компьютерная томография»). Также применяется в клинической практике методика метки артериальных спинов (Arterial spin labeling (ASL)), не требующая введения контрастного вещества, в качестве эндогенного контрастного вещества используется вода в составе артериальной крови. Обычно на артериальные спины наносятся магнитные метки с помощью последовательности инверсия-восстановление. Далее исследуемый срез подвергается насыщению (сатурации), в результате которой входящие ненасыщенные спины способствуют усилению сигнала относительно насыщенной ткани на конечном срезе. Меченые артериальные спины, выходящие из сосудистого русла во внеклеточное пространство, вызывают повышение сигнала в соответствующем регионе. (Станжевский А. А. Тютин Л. А. Роль перфузионных технологий в оценке гемодинамики опухолей головного мозга. Трансляционная медицина. 2015; 2(4): 41–47. )
Доказано, что совместное применение DWI и PWI – режимов улучшает качество визуализации, позволяя получить наиболее полную информацию о локализации и степени распространенности поражения в первые 48 часов от возникновения симптомов инсульта. К тому же, диагностически значимым является выявление диффузионно-перфузионного несоотвестсвия, которое представляет собой разницу между областями, охваченными DWI и PWI, эта разница, как правило, соответствует пенумбре, зоне «ишемической полутени». Недостатки диффузионно-перфузионного несоответствия, по большей части, методологические, и включают следующее:
- Недостаточное анатомическое соответствие зон DWI и PWI
- Различная чувствительность PWI в зависимоти от Тmax (время до пика кривой остатка)
- Оценка несоотвествия производится визуально
МРТ, зависимая от уровня кислорода в крови (Blood Oxygen Level-Dependent, BOLD)
Фракция кислородной экстракции (ФЭФ), измеренная методом позитронно-эмиссионной томографии (ПЭТ), считается критерием, стандартным для визуализации ишемической полутени при остром ишемическом инсульте. До появления данной методики оценка диффузионно-перфузионного несоответствия была единственным МРТ-методом визуализации области ишемической полутени. МРТ, зависимая от от уровня кислорода (BOLD) — метод, который позволяет обнаружить дезоксигемоглобин в церебральных капиллярах и венах, и использовать его как индикатор церебральной фракции экстракции кислорода.
МРТ-картина в различные периоды острого инсульта
Период 0–24 часа от возникновения симптомов
При проведении МРТ в DWI – режиме можно обнаружить ишемические изменения уже через несколько минут от возникновения симптомов.
Через несколько часов от развития инсульта (наилучшим образом на Т2-взвешенных изображениях) наблюдается (у 30–40% пациентов) потеря МР-сигнала от прохождения крови по сосудам. Через 2–4 часа в режиме Т1 отмечается сглаженность борозд вследствие цитотоксичекого отека. Через 8 часов на Т1-взвешенных изображениях наблюдается сигнал повышенной интенсивности, что обусловлено цитотоксическим и вазогенным отеком. На МРТ с контрастированием может рано возникать (у > 50% пациентов) повышение МР-сигнала прохождения крови по сосудам вследствие замедленного кровотока в зоне некроза, данный признак чаще всего исчезает по прошествии 1 недели. Существуют различия в интенсивности МР-сигнала от вещества головного мозга при сформировавшихся и несформировавшихся инфарктах. При сформировавшихся инфарктах она визуализируется на 5–7 день от развития симптомов инсульта и сохраняется несколько месяцев. При несформировавшихся инфарктах она может наблюдаться в течение 2–4 часов и обычно более интенсивена, чем при сформировавшемся инфаркте.
В таблице 3 представлены изменения на МРТ в различные периоды острого инсульта.
Таблица 3. Ишемические изменения на МРТ в зависимости от времени после развития симптоматики
| Время | МРТ-картина | Этиология |
|---|---|---|
| 2–3 минуты | DWI – снижение ADC-коэффицента | Снижение скорости движения протонов |
| 2–3 минуты | PWI — Снижение CBF, CBV, MTT | Снижение скорости церебрального кровотока |
| 0–2 часа | T2-WI – отсутствие эффекта потока (flow void) | Замедление кровотока или окклюзия |
| 0–2 часа | Т1-WI – артериальное усиление | Замедление скорости кровотока |
| 2–4 часа | Т1-WI – легкое сглаживание борозд | Цитотоксический отек |
| 2–4 часа | Т1-WI – паренхиматозное усиление | Несформировавшийся инфаркт |
| 8 часов | Т2-WI – гиперинтенсивность сигнала | Вазогенный и цитотоксический отек |
| 16–24 часа | T2-WI – гипоинтенсивность сигнала | Вазогенный и цитотоксический отек |
| 5–7 дней | Повышение интенсивности сигнала от вещества головного мозга | Сформировавшийся инфаркт |
Период 1–7 суток от возникновения симптомов
Поскольку отек достигает максимума в период 24–48 часов, зоны патологических очагов на МРТ четко разграниченны. Зона ишемии гиподенсивна в Т1 — WI режиме и гиперденсивна в T2-WI, также в этой зоне наблюдается масс-эффект. При использовании контраста наблюдается повышение интенсивности сигнала прохождения крови по сосудам, в то время как МР-сигнал вещества головного мозга приобретает повышенную интенсивность в конце этого периода.
Период 7–21 суток от возникновения симптомов
В этом периоде отек исчезает и масс-эффект становится менее выраженным, а зона инсульта гиподенсивна в Т1 — WI режиме и гиперденсивна в T2-WI. На изображениях с контрастным усилением отмечается повышенная интенсивность МР-сигнала прохождения крови по сосудам, а также вещества головного мозга. Повышение сигнала наблюдается также в области извилин коры головного мозга, подкорковые структуры гомогенны.
Период более 21 суток от возникновения симптомов
В этом периоде отек исчезает полностью, сохраняется гиподенсивность в Т1 — WI режиме и гиперденсивность в T2-WI в зоне инсульта. Вследствие уменьшения объема мозговой ткани за счет зоны инфаркта происходит ex-vacuo увеличение желудочков, а также расширение извилин и борозд коры головного мозга.
На изображениях с контрастным усилением характерной особенностью является повышение интенсивности сигнала от вещества головного мозга, которое обычно уже не наблюдается по прошествии 3–4 месяцев.
Нейровизуализация (МРТ-картина) различных патогенетических подтипов инфаркта головного мозга
Лакунарный инфаркт – небольшой по площади (менее 1,5 см) очаг расположен в глубинных отделах вещества головного мозга (рисунок 8). Причиной развития лакунарного инфаркта наиболее часто является липогиалиноз и фибриноидный некроз вследствие артериальной гипертензии. Наиболее частая локализация очага – базальные ганглии, внутренняя капсула, таламус, ствол мозга, мозжечок.
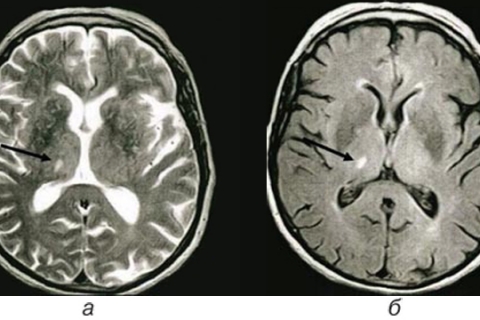
Рисунок 8. Лакунарный инсульт (постишемический очаг в базальных ядрах справа). МРТ головного мозга в режиме FLAIR
PRES (Posterior reversible encephalopathy syndrome) – синдром обратимой задней энцефалопатии. Клинические проявления: острое/подострое начало головной боли, приступы, зрительные галлюцинации, изменение психического состояния, иногда очаговая неврологическая симптоматика. На МРТ обычно визуализируются симметичные отграниченные зоны вазогенного отека, преимущественно в зонах кровоснабжения вертебро-базилярного бассейна. Как правило, изменения затрагивают белое вещество, но кора головного мозга также может быть вовлечена (рисунок 9). При применении диффузионно-взвешенного режима значение ADC-коэффицента обычно в норме или повышено, что позволяет дифференцировать вазогенный отек, вызванный гипертензией, от цитотоксического отека, вызванного ишемией.
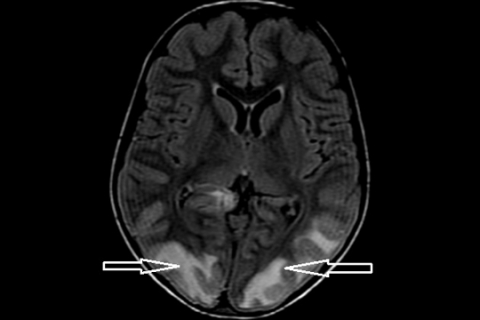
Рисунок 9. Задняя обратимая энцефалопатия (PRES-синдром). Вазогенный отек в теменно-затылочных долях
Тромбоэмболический инфаркт является самым частым патогенетическим подтипом. Как правило, на МРТ наблюдается клиновидный инфаркт в соответствующей области кровоснабжения (рисунок 10). Для выявления очага используются Т1 — и Т2-режимы, DWI.
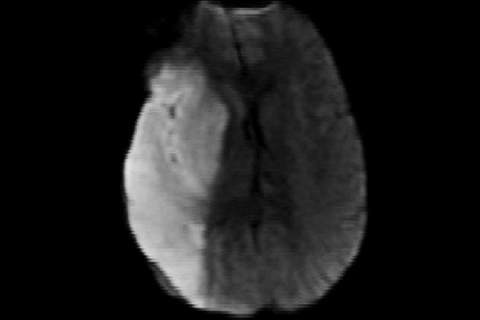
Рисунок 10. МРТ головного мозга в DWI-режиме. Стрелкой указана зона ишемических изменений в правом полушарии головного мозга
Инфаркт в области водораздела локализуется в смежных участках определенных территорий артериального кровоснабжения. Очаг может располагаться как поверхностно, так и глубоко в паренхиме мозга. Этиологическими факторами могут быть системная гипотензия, остановка дыхательной и сердечной деятельности, проксимальный артериальный грубый стеноз или окклюзия. Исследования показывают, что этот тип инфаркта может быть легче всего обнаружен с помощью DWI (рисунок 11).
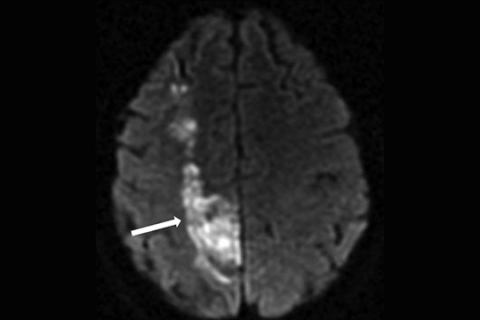
Рисунок 11. МРТ головного мозга в DWI-режиме Инфаркт головного мозга на стыке бассейнов передней и средней мозговых артерий
Окклюзия церебральных вен и венозных синусов обычно вызвана как системными состояниями, такими как беременность, васкулиты, воспалительные заболевания, гиперкоагуляционный статус, так и локальными состояниями – инфекция, неоплазия, травма. Окклюзия венозной структуры приводит к невозможности венозного оттока, результатом которого являются паренхиматозные инфаркты и геморрагии.
Обычно такие пациенты госпитализируются в конце острой фазы или в подострую фазу, что существенно затрудняет постановку диагноза. На МРТ можно отметить утрату сигнала венозной циркуляции, отсутствие нормального венозного расширения, визуализацию гиперинтенсивного сигнала на Т1-и Т2 — взвешенных изображениях (рисунки 12а, 12б). Картина обычно двусторонняя и не охватывает территории артериального кровоснабжения.
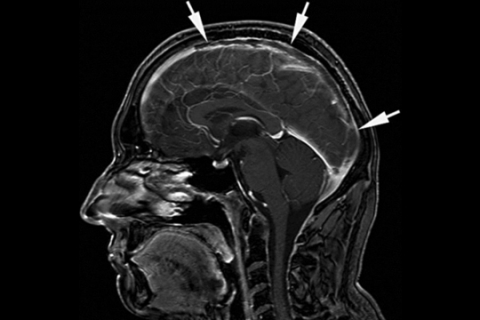
Рисунок 12а. МРТ головного мозга: тромбоз сагитального синуса.
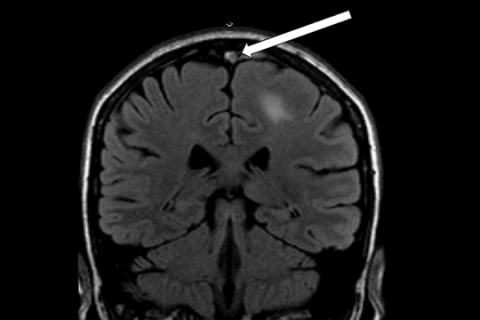
Рисунок 12б. При МРТ головного мозга: признаки тромбоза сагиттального синуса с развитием венозного инфаркта левой теменной доли