Чувствительная и болевая иннервация лица
Чувствительные и болевые стимулы от лица воспринимает, перерабатывает и передаёт тригеминальная сенсорная система. Она состоит из периферического отдела (чувствительные рецепторы, ветви тройничного нерва и тройничный (Гассеров или полулунный узел) и центральных структур (комплекс чувствительных ядер тройничного нерва).
Первые нейроны тригеминальной сенсорной системы имеют псевдоуниполярное строение — центральный и периферический отросток следуют в месте до разделения. Тела первых нейронов находятся в Гассеровом узле.
Периферические отростки псевдоуниполярных нейронов Гассерова узла образуют три ветви тройничного нерва: V1 (глазная), V2 (верхнечелюстная) и V3 (нижнечелюстная).
Верхняя часть головы, оболочки мозга передней и средней черепной ямок, роговица иннервируются преимущественно глазной ветвью, верхняя губа, верхняя челюсть (зубы, слизистая оболочка) — верхнечелюстной ветвью, нижнечелюстная ветвь иннервирует преимущественно нижнюю челюсть, нижнюю губу.
Ветви V1 и V2 чисто чувствительные, а V3 содержит как чувствительные, так и двигательные волокна, обеспечивающие иннервацию жевательных мышц.
По строению, среди волокон тройничного нерва выделяются следующие типы:
- Aδ (промежуточная степень миелинизации и скорости проведения) и
- C (немиелинизированные) — преимущественно проводники болевой и, в меньшей степени, температурной и тактильной чувствительности (свободные нервные окончания в тканях, выступающие в роли низкопороговых механорецепторов), и
- Aα и Aβ волокна (проводники неболевой, в том числе проприоцептивной чувствительности, ассоциированные с мышечными веретёнами и тельцами Гольджи, свободные нервные окончания, выполняющие функцию низкопороговых механорецепторов).
В составе тройничного нерва млекопитающих доля миелинизированных волокон значительно больше, чем в составе соматических нервов, что отражает биологическую важность регистрации и передачи тактильной информации от краниофациальной области.
Активация рецепторов и афферентных окончаний приводит к выработке потенциалов действия в ассоциированных волокнах, их распространению в ЦНС. Этим импульсы несут информацию о локализации, качестве, интенсивности и продолжительности стимулов, действующих на нервные окончания, и, в случае болевых рецепторов, запускают безусловные защитные рефлексы (например, мигательный и слёзовыделительный), обеспечивают выработку аффективной окраски боли.
Возможно стойкое повышение возбудимости болевых рецепторов после повреждения или воспаления ткани, вплоть до развития текущей (»спонтанной») активности и становятся более чувствительными к болевым стимулам или реагировать на стимулы, которые не являются болевыми. Этот процесс называется «периферическая сенситизация».
Рисунок 1. Чувствительная иннервация головы
.jpg)
Активация или периферическая сенситизация свободных нервных окончаний — болевых рецепторов — происходит с вовлечением нескольких видов веществ-медиаторов, встречающихся также и в ЦНС (АТФ, глутамат, гамма-аминомасляная кислота — ГАМК), серотонин и норадреналин, а также — нейропептиды. Важную роль в сенсетизации ноцицептивных структур играют глиальные клетки (Launay, P. S. Reboussin, E. 2016).
Сенситизация активизируется процессами синтеза и сборки ионных каналов, включая каналы с транзиторным рецепторным потенциалом, выработкой нейропептидов, мозгового нейротрофического фактора и других белковых молекул. Изменения транскрипции отдельных белков могут быть следствием повреждения нерва. Хроническое воспаление может быть следствием спонтанной активности нервных окончаний.
Комплекс чувствительных ядер тройничного нерва (VBSNC) — вторые нейроны — группа клеток, где образуются синаптические связи большинства сенсорных афферентов тройничного нерва со вторыми нейронами. Здесь происходит переработка и модуляция сенсорной информации. В лабораторных исследованиях получены данные об активизации клеток данной области под действием болевых импульсов (Broton с соавт. 1988; Hu, 1990; Kojima, 1990; Dostrovsky с соавт. 1991; Nishida и Yokota, 1991; Hu с соавт. 1992a; Mokha, 1993; Peppel и Anton, 1993; Pozo и Cervero, 1993; Yu с соавт. 1993: Chiang с соавт. 1994,1997,1998; McHaffie с соавт. 1994; Wang с соавт. 1996; Zhang с соавт. 1996; Meng с соавт. 1997; и см. Dubner с соавт. 1978; Dubner и Bennett, 1983; Yokota, 1985; Sessle, 1987,1996, цит. по Sessle, B. J. (2000)).
Комплекс чувствительных ядер тройничного нерва включает три основных чувствительных ядра:
- среднемозговое ядро (в центральном околоводопроводном сером веществе ножки мозга) — nucleus mesencephalicus — объединяет импульсы глубокой (проприоцептивной) чувствительности мышц лица, нёба, шейных мышц выше подъязычной кости и мышцы, напрягающей барабанную перепонку; отростками клеток этого ядра являются миелинизированные волокна Aα и Aβ в составе тройничного нерва.
- мостовое (главное) ядро — nucleus pontinus, nucleus principalis nervi trigemini — обеспечивает передачу тактильной чувствительности от лица,
- ядро спинального пути — nucleus spinalis распространяется до дорсальных рогов спинного мозга, сохраняя отчётливые слои клеток, сходно со строением задних рогов спинного мозга; состоит из subnucleus oralis (Vo), subnucleus interpolaris (Vi) и subnucleus caudalis (Vc)[1]. Последнее считается наиболее значимым в передаче болевых импульсов. Волокна C — и Aδ образуют синаптические связи в слоях I, II, V и VI, как и в задних рогах спинного мозга (ядро спинального пути вместе с задними рогами C1 — C4 сегментов спинного мозга формируют тригеминоцервикальный комплекс). Чувствительное получает афферентные волокна болевой чувствительности от других черепных нервов: лицевого, языкоглоточного и блуждающего (Hu, J. W. & Woda, A. (2013).
Центральные окончания Aδ и C ноцицептивных афферентов высвобождают ряд возбуждающих нейротрансмиттеров или нейромодуляторов, таких как возбуждающая аминокислота глутамат и пептиды — субстанция Р и пептид, связанный с геном кальцитонина (CGRP). Эти вещества возбуждают вторые нейроны, с которыми афференты образуют синапсы.
Первый тип болевых нейронов, которые активируются болевыми стимулами (например, уколы, жар), нанесёнными на локализованные чувствительные области (например, на кожу) Aδ и C афферентов.
Указывается на возможность центральной регуляции передачи болевой информации от стволовых ядер к надъядерным (таламус, кора головного мозга) структурам.
Рисунок 2. Модуляция структур каудальной части спинального ядра тройничного нерва
.jpg)
Клиническая классификация лицевых болей
Махинов К. А. Баринов А. Н. 2015 г.
1. Зубная ЛБ:
2. Не зубная ЛБ:
а) скелетно-мышечные боли,
включая поражение височно-нижнечелюстного сустава;
б) невралгии и невропатические болевые синдромы: тригеминальная, глоссофарингеальная, сфенопалатинная невралгии; посттравматическая невропатия с развитием невропатической боли; синдром жжения полости рта, постгерпетическая невралгия[2];
в) идиопатическая орофациальная боль;
г) связанные с поражением слизистой: иммунологические, инфекционные, эрозивные, язвенные и везикуло-буллезные повреждения;
д) психосоматическая патология;
е) синоназальная боль;
ж) вариант головной боли, при мигрени, головной боли напряжения, опухоли или аневризмы;
з) заболевания слюнных желез — сиалоаденит, сиалолитиаз;
и) кардиальная боль с иррадиацией в нижнюю челюсть.
Тригеминальная невралгия (МКБ-11 8B82.0)
Выделяется три больших вида тригеминальной невралгии:
- классическая[3]: признаки нейроваскулярного конфликта по данным МРТ или интраоперационной ревизии в сочетании с признаками изменения корешка тройничного нерва;
- вторичная: установлена отличная от нейроваскулярного конфликта причина невралгии, объясняющая развитие симптомов у пациента;
- идиопатическая: в ходе обследования исключены состояния, вызывающие тригеминальную невралгию.
Классическая и идиопатическая ТН также подразделяется на «чисто пароксизмальную» или «с сопутствующей персистирующей головной болью».
Нейроваскулярный конфликт
Сдавление ствола тройничного нерва кровеносными сосудами (в порядке убывания значимости: верхняя мозжечковая артерия, передняя нижняя мозжечковая артерия, вены головного мозга, Kulkarni, A. 2022) непосредственно в месте входа в варолиев мост — нейроваскулярный конфликт — наиболее частая причина ТН.
Нейроваскулярный конфликт устанавливается на основании контакта сосуда задней черепной ямки и ствола тройничного нерва при проведении МРТ головного мозга с использованием тонкосрезовых МР-последовательностей, таких как FIESTA. Наибольшее значение в диагностике имеют диаметр прилежащей к тройничному нерву артерии, отношение диаметров интрацистернальной порции тройничного нерва в воротной зоне и протяженность нейроваскулярного контакта (Бакунович А. В. 2021).
Переходная зона между центральным и периферическим типом миелиновой оболочки протяжённостью около 4 мм — наиболее уязвимый участок нерва (Haller, S. Etienne, L. 2016). При электронной микроскопии, образцов, полученных при ризотомии у пациентов с ТН, во всех случаях выявлена демиелинизация данной области в сочетании с глиозом и воспалительными изменениями. Эти изменения приводят к гипервозбудимости аксонов и нейронов, потерявших связь с аксонами (аксотомизированных). Близкое соприкосновение демиелинизированных аксонов создаёт условиях для электротонического распространения возбуждения с одного на другие — эфаптическая передача (Тюрников В. М. Переседова А. В. 2012). Данный набор представлений получил название теория «воспламенения» (ignition hypothesis).
Сдавление тройничного нерва без развития структурных изменений последнего выявляется у асимптомных пациентов и обозначается термином нейроваскулярный контакт.
В исследовании Maarbjerg, S. Wolfram, F. (2015) была показана убедительная связь между нейроваскулярным конфликтом и развитием классической тригеминальной невралгии
По данным ретроспективного исследования с участием 135 пациентов с тригеминальной невралгией, тяжёлые случаи нейроваскулярного конфликта чаще встречались у мужчин (75%), по сравнению с женщинами (38%)(p < 0.001), доля случаев на стороне развития симптомов была в 5,1 раз больше у мужчин, чем у женщин (95% ДИ 2,3–10,9, p < 0,001). Не было различий между пациентами с тяжёлым нейроваскулярным конфликтом и без по возрасту (≥60 лет, против <60) (ОШ 1,6 95% ДИ (0.8–3.4), p = 0.199) или продолжительности заболевания (p = 0.101).
Несмотря на то, что сдавление ствола тройничного нерва считается основной причиной классической тригеминальной невралгии, каскад механизмов, приводящих к появлению симптомов ТН не до конца изучен. Сдавление нерва сопровождается демиелинизацией ствола и развитием воспалительных изменений. Были выявлены признаки повреждения шванновских клеток и дистрофии аксонов; в патогенез ТН вовлечены дизрегуляция работы ионных каналов и изменение синтеза их белков. Итогом изменения состава ионных каналов нервных клеток при ТН является повышение возбудимости клеточных мембран (Chen, Q. Yi, D. I. Perez, J. N. J. 2022).
Повторные приступы интенсивной лицевой боли вызывают ожидаемые изменения в центральных структурах ноцицептивной системы.
Причины вторичной тригеминальной невралгии
Герпетическая инфекция (вирус опоясывающего герпеса), гнойные воспалительные заболевания (остеомиелит костей основания черепа), опухоли (как нерва, так и окружающих структур, включая мозговые оболочки, с объёмным воздействием на нерв) и кисты, сосудистые аномалии, псевдоопухоли и саркоидоз, рассеянный склероз и другие демиелинизирующие заболевания ЦНС, последствия краниофациальных травм и хирургических, в том числе стоматологических, вмешательств.
Роль сенситизации центральных ноцицептивных структур
Развитие идиопатической тригеминальной связывают с сенситизацией структур ноцицептивной системы (например, по причине нарушения потока афферентных импульсов после экстракции зубов) Zurak N, Mahovic D. (2019). В случаях хронического течения лицевых болей, резистентных к лечению, сенситизация рассматривается как важный механизм.
Клиника тригеминальной невралгии
Расстройство, которое характеризуется повторными односторонними кратковременными приступами боли с быстрым началом и быстрым концом, сходными с ощущениями при ударе электрического током. Подавляющее большинство (до 97%) приступов провоцируются пусковыми факторами (Di Stefano, G. Maarbjerg, S. 2018): лёгким прикосновением к лицу — губы и носогубные складки, крылья носа, брови (у 79% пациентов) и другими неболевыми раздражителями (дуновением ветра, действием холода или тепла), участием мимических мышц в повседневных активностях, включая, речь (54% пациентов) и приём пищи.
У небольшой доли пациентов приступы ТН могут вызываться необычными воздействиями, включая сгибание корпуса, движения глаз (Di Stefano, G. Maarbjerg, 2018).
Характерно распределение боли в соответствии с областями иннервации ветвей тройничного нерва.
Распределение боли чаще одностороннее. Приблизительно в 60% случаев заболевание вовлекает только одну ветвь — верхне — или нижнечелюстную, в 35% случаев вовлекаются обе ветви. Офтальмическая ветвь вовлекается крайне редко, приблизительно в 4% случаев (Maarbjerg, S. Gozalov, A. (2014).
Клинические наблюдения о том, что приступы ТН возникают чаще справа (у 60–70% пациентов) до сих пор не имеют непротиворечивых объяснений (Obermann, M. 2012).
Доля пациентов с двусторонними приступами минимальна (1,7–5%), в этом случае у пациентов чаще возникают односторонние приступы, но сторона их локализации меняется. По причине редкости, в случае двустороннего характера боли требуется исключение фоновых неврологических заболеваний и поражения черепа. При нормальных результатах исследований, в качестве возможных причин рассматриваются патология височно-нижнечелюстного сустава, персистирующая идиопатическая лицевая боль, редко — мигрень, ассоциированная с лицевой болью. В случаях коротких пароксизмов боли, необходимо оценить возможность связи боли с вегетативной тригеминальной цефалгией (короткие приступы односторонней невралгической головной боли с черепными автономными симптомами, SUNA), если боль сочетается с вегетативными симптомами или идиопатическая стреляющая головная боль, при вовлечении офтальмической (V1) ветви тройничного нерва (Lambru, G. Zakrzewska, J. 2021).
Burchiel K. J. с соавт. и Eller J. L. с соавт. венозный нейроваскулярный конфликт включают в отдельную группу по причине различий симптомов (наличие постоянного жгучего болевого ощущения на фоне типичных для ТН периодических приступов) и большей частоты рецидивов после МВД (Бакунович А. В. 2021).
Классификация тригеминальной невралгии
Ниже приводятся наиболее распространённые диагностические критерии тригеминальной невралгии из Международной классификации головной боли 3 пересмотра.
Диагностические критерии тригеминальной невралгии (13.1. 1 МКГБ-3)
- Боль соответствует всем нижеперечисленным характеристикам:
- продолжительность от нескольких секунд до 2-х минут;
- высокая интенсивность;
- сходство с ударом электрическим током, острый колющий или стреляющий характер;
- Вызывается неболевыми стимулами, которые наносятся на ту же сторону лица;
- В МКГБ-3 нет определения альтернативного диагноза, которое лучше описывает состояние пациента.
Примечания:
У отдельных пациентов может отмечаться другой характер иррадиации в пределах дерматомов, иннервируемых тройничным нервом.
Продолжительность с течением времени может меняться, приступы становятся более длительными. Небольшая часть пациентов может сообщать о том, что приступы чаще всего продолжаются > 2 минут.
С течением времени боль может становится более интенсивной.
Некоторые приступы могут быть или казаться спонтанными, но для соответствия этому критерию необходимы анамнестические или объективные данные о развитии боли под действием неболевых стимулов. Идеально, когда при обследовании пациента активно выявляется факт развития спровоцированных болевых приступов. Однако, такой подход может быть неосуществим по причине отсутствия адекватных данных от пациентов, необычной анатомической локализации триггеров и/или других факторов.
Комментарии:
Диагноз 13.1. 1 Тригеминальной невралгии должен быть установлен клинически. При обследовании пациента необходимо установить наиболее вероятную причину.
У большинства пациентов с ТН, имеющими характерные пусковые факторы, без использования специальных методов (количественная оценка чувствительности) не удаётся выявить сенсорных нарушений в области изолированной иннервации ветвей тройничного нерва. В некоторых случаях, неврологическое обследование может выявить чувствительные выпадения, что указывает на необходимость нейровизуализации для установления возможной причины.
На основании результатов обследования выделяются подтипы 13.1. 1.1 Классическая тригеминальная невралгия, 13.1. 1.2 Вторичная тригеминальная невралгия или 13.1. 1.3 Идиопатическая тригеминальная невралгия.
Боль высокой интенсивности часто вызывает сокращение мышц на поражённой стороне (tic douloureux).
Могут отмечаться вегетативные симптомы, такие как слёзотечение и/или покраснение глаза на стороне боли.
После приступа боли обычно возникает рефрактерный период, во время которого невозможно вызвать приступ.
Данная классификация ТН требует проведения МРТ головного мозга каждому пациенту. Существуют другие подходы к классификации ТН (Rasmussen, P. 1990, Burchiel K. J. 2005).
Тригеминальная невралгия (ТН) может развиваться без явной причины или быть следствием другого диагностируемого расстройства, может протекать на фоне другого типа лицевой боли более низкой интенсивности. Развитие сопутствующей постоянной пульсирующей или жгучей боли отмечается у 30–49% пациентов в срок от 1,5 лет с момента появления первых симптомов (Haviv, Y. Khan, J. Zini, 2016, Maarbjerg, S. Gozalov, A. 2014).
Классическая ТН обычно вовлекает вторую и третью ветви тройничного нерва. Боль никогда не переходит на противоположную сторону, но, в редких случаях, она может возникать одновременно с обеих сторон. После приступа боли, как правило следует промежуток времени, когда развитие боли нельзя спровоцировать. При высокой интенсивности, боль часто вызывает сокращение мимических мышц на поражённой стороне (tic douloureux).
На стороне поражения могут отмечаться лёгкие вегетативные симптомы — слёзотечение и/или покраснение глаз.
Большинство пациентов могут указать время начала боли. Между приступами у большинства пациентов, как правило, нет никаких жалоб.
Продолжительность приступов боли может изменяться, с течением времени они становятся более продолжительными и интенсивными. Они могут приводить к психосоциальным ограничениям на фоне тревожных и депрессивных симптомов, значительно ухудшать качество жизни и быть причиной снижения массы тела пациентов (Zakrzewska, J. M. Wu, J. Mon-Williams, 2017).
Гипестезия или гипалгезия в вовлечённой области иннервации тройничного нерва всегда указывает на аксональное повреждение. При этом предполагается тригеминальная невропатия и проводится поиск возможных причин симптоматической лицевой боли.
Указывается на большую распространённость выпадений тригеминальных рефлексов (мигательный на тактильные стимулы, роговичный и массетерный ингибиторный рефлекс, нижнечелюстной (Рыбалкина-Бехтерева) при вторичной ТН.
У существенной части пациентов с вторичной ТН нет неврологических выпадений, что снижает специфичность данного клинического признака для этого типа ТН. У ряда пациентов, в области распространения боли отмечается гипералгезия, что не обязательно должно рассматриваться как проявление тригеминальной невропатии, поскольку это может быть следствием повышенного внимания пациента к болезненной стороне.
Классическая ТН предполагает связь с нейроваскулярным конфликтом — наиболее часто, сдавлением ствола нерва верхней мозжечковой артерией и отсутствии других предполагаемых причин. Клинических характеристик, позволяющих надёжно разделить пациентов с первичной и вторичной тригеминальной невралгией не выявлено, пациентам с подозрением на вторичную ТН настоятельно рекомендовано проведение магнитно-резонансной томографии (МРТ) головного мозга (Bendtsen, L. Zakrzewska, J. M. 2019).
Эпидемиология
Распространённость ТН находится в диапазоне от 0,03% (95% ДИ 0,01–0,08) до 0,3% (ДИ 0,16–0,55), женщины чаще мужчин (соотношение по данным литературы 1:3 — 2:3).
ТН чаще возникает у пациентов в возрасте старше 50 лет (Montano N, Conforti G, 2015) — средний возраст начала 53–57 лет, диапазон по данным оценки серий взрослых пациентов от 24 до 93 лет (Maarbjerg, S. Gozalov, A. 2014). У большинства пациентов с ТН есть признаки сдавления ветвей тройничного нерва сосудами задней черепной ямки.
Примечательно, что лицевые боли значительно чаще встречаются у пациентов с сосудистыми головными болями: мигренью, кластерной головной болью и вегетативной тригеминальной цефалгией. ТН также в 15–20 чаще встречается у пациентов с рассеянным склерозом, чем в общей популяции Gerwin, R. (2020).
При оценке данных 2912 пациентов, обратившихся в специализированный центр университетской клиники в связи с первичными головными болями, 291 пациент указывал на лицевую боль, как на изолированный, так и сочетающийся с головной болью симптом. В группе пациентов с мигренью о лицевой боли сообщали 2,3% (44 из 1935) пациентов. Наиболее часто, симптомы распространялись в области иннервации V2 тройничного нерва, из них у 18 пациентов (40,9%) боль отмечалась преимущественно в лице. В группе пациентов с кластерной головной болью, 14,8% (42 из 283) сообщали о симптомах лицевой боли, из них преимущественно лицевую боль отмечали у себя 31,0%. У пациентов с пароксизмальной гемикранией, сопутствующие лицевые боли отмечались у 45% (9 из 20), также, у 21,4% пациентов с hemicrania continua (9 из 42), и у 20% пациентов с кратковременными односторонними невралгическими головными болями с инъецированием конъюнктивы и слезотечением — синдром КОНКС (SUNCT-синдром) в 3 из 15-ти случаев.
Тригеминальная невралгия с сопутствующей персистирующей лицевой болью
Диагностические критерии
A. Повторные приступы односторонней лицевой боли, соответствующие критериям тригеминальной невралгии.
B. Стойкая лицевая боль умеренной интенсивности и вовлечённой области.
C. В МКГБ-3 нет определения альтернативного диагноза, которое лучше описывает состояние пациента
Лечение тригеминальной невралгии
Фармакотерапия
Подавляющее число средств, эффективных для лечения тригеминальной невралгии — противоэпилептические препараты, эффективность которых была установлена эмпирически.
Препараты «первого ряда»
Карбамазепин
.jpg)
«Золотой стандарт» лечения ТН, который используется с конца 1960-х годов (Rockliff, B. W. & Davis, E. H. 1966). Это единственный препарат, зарегистрированный FDA для лечения тригеминальной невралгии. Эффективность препарата при первичном назначении оценивается в 70–80%. Препарат часто эффективен в дозах, меньших, чем назначаются при эпилепсии — 100 мг х 2–3 раза в день. Поддерживающая доза в диапазоне 300–800 мг/сут. Приём препарата нередко сопровождается тахифилаксией (снижением эффективности при повторном приёме), что приводит к необходимости повышения дозы. При длительном приёме карбамазепина, эффективность препарата снижается до 50%. Число больных, которых необходимо лечить, ЧБНЛ, 2,6 (95% ДИ 2,0–3,4) Wiffen, P. J. Collins, S. (2005).
Действие препарата — блокатора натриевых каналов — связывается с подавлением синаптической передачи в ядре спинномозгового пути тройничного нерва и на уровне таламуса.
При назначении карбамазепина пациентам нарушениями внутрисердечной проводимости, пациентам с депрессией на момент назначения или в анамнезе, особенно с суицидальными мыслями, а также, пациентам монголоидной расы (часто встречается аллель HLA-B*1502, сочетающийся с высоким риском фатальных дерматологических реакций, включая токсико-эпидермальный некролиз и Стивенс-Джонсона) необходимо обеспечить динамическое наблюдение с повторными амбулаторными осмотрами и необходимыми обследованиями.
Приём препарата сопровождается риском множественных лекарственных взаимодействий. Карбамазепин существенно ускоряет метаболизм варфарина, увеличивая дозу, необходимую для поддержания целевого МНО (Mannheimer B, Andersson ML, 2016); может снижать эффективность и безопасность оральных контрацептивов.
Карбамазепин метаболизируется преимущественно CYP3A4, изоформа цитохрома P450, которая встречается в печени и тонкой кишке. Препарат является мощным индуктором CYP3A4 и других ферментов окислительного метаболизма в печени, с чем связано усиление разрушения препарата с повышением его дозы. Фенитоин, фенобарбитал и примидон усиливают выведение карбамазепина, возможно, также оказывая стимулирующее воздействие на цитохром P450 (CYP) 3A4, вызывая клинически значимое уменьшение концентрации препарата в плазме.
Подавление метаболизма карбамазепина и повышение концентрации препарата в плазме до потенциально токсических концентраций может вызываться ацетазоламидом, антибиотиками-макролидами, метронидазолом, изониазидом, отдельными антидепрессантами, антагонистами кальция: верапамилом и дилтиаземом, циметидином. Симптомы отравления препаратом могут быть вызваны повышением концентрации активного метаболита — карбамазепин-10,11-эпоксида ввиду снижения активности эпоксид гидролазы при приёме вальпроевой кислоты.
Требуется осторожность при назначении карбамазепина пациентам с сопутствующими заболеваниями печени. В начале лечения рекомендуется контроль уровня трансаминаз крови 2–4 раза в неделю, чтобы своевременно выявить гепатотоксическое действие.
Окскарбазепин
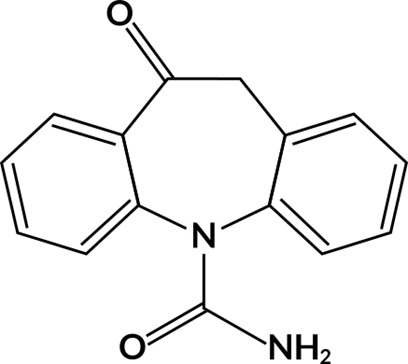
10-оксопроизводное карбамазепина. В отличие от карбамазепина, активная форма окскарбазепина не обладает свойствами индуктора цитохрома Р-450 (не усиливает собственный метаболизм с повышением дозы) и не превращается в токсический эпоксид.
При первичном назначении, эффективность окскарбазепина сходна с карбамазепином. Препарат эффективен приблизительно у двух третей пациентов, резистентных к карбамазепину. Может использоваться в дозе до 900 — 2400 мг/сут, поддерживающая доза обычно составляет 300–600 мг х 2 раза в день.
В ретроспективном сравнительном исследовании в условиях реальной клинической практики (G. Stefano, G. Stefano, 2021), эффективность карбамазепина и окскарбазепина была сходной (на лечение отвечали 88,3% и 90,9% пациентов соответственно). Приём карбамазепина значительно чаще сопровождался развитием побочных эффектов (43,6% и 30,3% соответственно, p < 0,0001), в том числе тяжёлых (29,6 и 12,6% соответственно).
Указывается на выраженные индивидуальные различия в эффективности и безопасности препаратов
Описана перекрёстная аллергия на карбамазепин и окскарбазепин (Bendtsen, L. Zakrzewska, J. M. 2019).
Появляющиеся в начале лечения нежелательные явления — чувство усталости, сонливость, ухудшение памяти, нарушения сна, нарушения понимания, концентрации внимания (Besi, E. Boniface, D. R. 2015). Эти симптомы, как правило, быстро исчезают при медленной титрации дозы препарата.
Препараты «второго ряда»
Ламотриджин
Механизм действия Ламотриджина связан с блокадой потенциал-зависимых натриевых каналов, препарат стабилизирует мембраны нейронов и подавляет выброс возбуждающих нейромедиаторов.
В двух систематических обзорах оценивались два двойных слепых перекрёстных рандомизированных контролируемых исследования, в которых ламотриджин сравнивался с плацебо (одновременный приём того или другого с карбамазепином или фенитоином в фиксированной дозе в течение 31 дня). Каждая часть исследования продолжалась 2 недели с 3-х дневным периодом «вымывания». Поддерживающая доза ламотриджина составляла 400 мг. В этом исследовании было показано, что ламотриджин в комбинации с карбамазепином или фенитоином был немного более эффективен, чем плацебо. Нежелательные явления при приёме ламотриджина были связаны с центральной нервной системой и носили дозозависимый характер. Один из пациентов прекратил участие в исследовании по причине интенсивной боли на фоне приёма плацебо.
В перекрёстном исследовании с участием 21 пациента с ТН сравнивались ламотриджин (400 мг) и карбамазепин 1200 мг. При приёме Карбамазепина интенсивность боли уменьшилась у 90,5% (19/21) пациентов, а ламотриджина — у 62 % (13/21) пациентов (в обоих случаях использовалась визуальная аналоговая шкала и вербальная рейтинговая шкала) (Shaikh S. Yaacob H. B. 2011). В числе описанных нежелательных явлений были головная боль, головокружение и кожная сыпь (7–10%), при этом, частота жизнеугрожающих осложнений, таких как синдром Стивенс-Джонсона, крайне мала. Медленная титрация дозы препарата позволяет избежать нежелательных явлений (Zakrzewska J. M. Chaudhry Z. 1997).
Баклофен
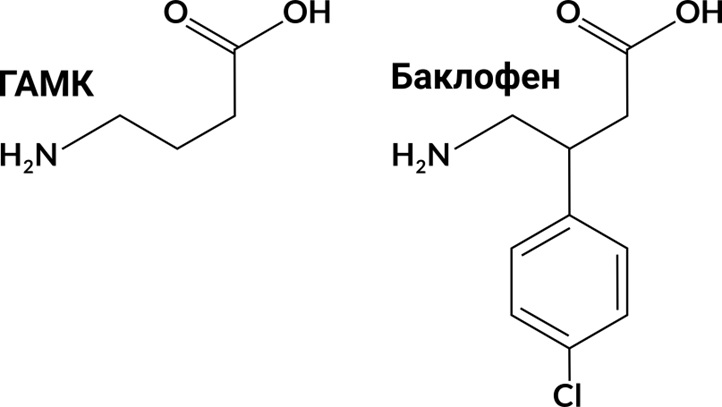
Баклофен — производное нейромедиатора — γ — аминомасляной кислоты (ГАМК), является агонистом ГАМК B рецепторов.
Пиковая концентрация в плазме достигается через 1 час после приёма препарата внутрь, время полувыведения около 4-х часов, в связи с этим, для контроля боли необходим трехкратный приём препаратов.
Препарат хорошо переносится, в начале приёма препарата пациенты могут отмечать седативное действие и дискомфорт в животе. Баклофен выводится преимущественно мочой в неизменном виде, а 15% дозы метаболизируется в печени посредством дезаминирования.
У пациентов с умеренным снижением функции почек (стадия ХБП 3А и выше — оценка скорости клубочковой фильтрации 30–60 мл/мин/1.73м2) рекомендуется уменьшение дозы препарата, а у пациентов с тяжёлым снижением функции почек (оценка скорости клубочковой фильтрации < 30 мл/мин/1.73м2) или которым проводится гемодиализ, рекомендуется избегать приёма препарата (Wolf, E. Kothari, N. R. 2018).
Также, как карбамазепин/окскарбазепин, баклофен снижает возбудимость нейронов механорецепторов в subnucleus oralis ядра спинального пути. В двойном слепом перекрёстном исследовании с участием 10-ти пациентов было показано, что баклофен снижает количество спазмов в течение дня. У семи пациентов результат достигал статистической значимости, в среднем с 11 до 2,22 в день. В «открытом» продолжении исследования, включающем дополнительно 50 пациентов, у которых приём карбамазепина не сопровождался необходимым эффектом или вызывал неприемлемые осложнения, 74% пациентов описывали снижение интенсивности и частоты приступов через 2 недели лечения. Комбинация баклофена с карбамазепином или фенитоином была более эффективна чем монотерапия баклофеном или каким-либо другим препаратом (Fromm, G. H. Terrence, C. F. 1984).
Экспертный консенсус считает, что назначение баклофена целесообразно при развитии ТН у пациентов, страдающих рассеянным склерозом. Эти пациенты часто уже принимают баклофен для уменьшения спастичности, что может обеспечивать контроль симптомов без дополнительного назначения карбамазепина. Наиболее распространёнными нежелательными явлениями при приёме баклофена могут быть кратковременное седативное действие препарата и снижение мышечного тонуса. Резкая отмена препарата может вызвать эпилептические припадки и галлюцинации (Zakrzewska, J. M. Linskey, M. E. 2015).
Препараты «третьего ряда»[4]
Габапентин
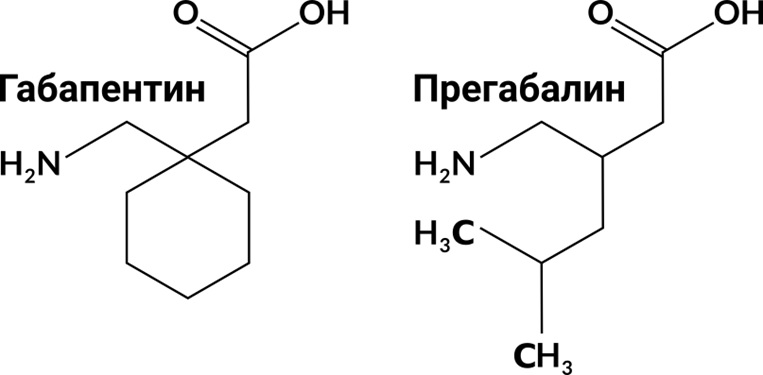
«Габапентиноиды» — габапентин и прегабалин, противоэпилептические препараты со сходным механизмом действия, блокаторы α2d вспомогательных субъединиц потенциалзависимых медленных кальциевых каналов.
Фармакологическое действие препаратов снижает возбудимость нейронов и их способность выделять нейромедиаторы; кроме того, было показано, что они подавляют подпороговые колебания мембранного потенциала, тем самым блокируя возникновение пачечной активности в ноцицептивных нейронах.
Мембраностабилизирующее действие габапентиноидов связывается с избирательным влиянием на медленный компонент Na+ проводимости, однако, требует уточнения, связано ли это с прямым влиянием на Na+ каналы или опосредованно со связыванием с α2d субъединицами потенциалзависимых медленных кальциевых каналов.
Химическая структура «габапентиноидов» сходна со строением тормозного медиатора — ϒ — аминомасляной кислоты (ГАМК).
Препарат не метаболизируется в организме и выводится почками в неизменном виде, что требует коррекции дозы у пациентов с почечной недостаточностью.
Среди препаратов «второго ряда» габапентин лидирует по количеству выполненных рандомизированных клинических исследований эффективности в лечении ТН и числу их участников. При этом большинство результатов работ опубликовано на китайском языке. Указывается на хорошую переносимость препарата и эффективность в дозе 100–3600 мг/сут (в среднем 930 мг/сут) (Lambru, G. Zakrzewska, J. 2021).
Препарат может использоваться в случаях, резистентных к лечению препаратами первого ряда (Cheshire, W. P. (2002).
После разового приёма, пиковая концентрация препарата достигается через 2–4 часа, время полувыведения составляет 5–7 часов.
К числу нежелательных явлений, сопровождающих приём препарата указывается на головокружение, спутанность сознания, общую слабость, нарушения координации движений, гастроинтестинальные симптомы, набор массы тела; указывается на необходимость особого внимания при одновременном назначении с опиоидами.
Прегабалин
После разового приёма, пиковая доза препарата достигается через 1,5 часа (при приёме одновременно с пищей — через 3 часа), время полувыведения препарата — 6 часов. Набор нежелательных явлений при приёме препарата сходен с таковым при приёме габапентина; приём прегабалина несколько чаще сопровождается периферическими отёками. В редких случаях, приём прегабалина сопровождается развитием тромбоцитопении.
Использование прегабалина для лечения пациентов с ТН основано на клиническом опыте и результатах небольших исследований. Данных крупных рандомизированных клинических исследований об эффективности препарата нет (Bendtsen, L. Zakrzewska, J. M. 2019).
В открытом проспективном исследовании с участием 53 пациентов, которые наблюдались в динамике в течение года, основная конечная точка (снижение интенсивности боли > 50% и уменьшение частоты приступов > 50% через 8 недель приёма) достигалась у 26 пациентов (49%), из них 13 (26%) сообщили о полном избавлении от боли. 14 (26%) пациентов не отмечали улучшения. Отмечается более низкая эффективность препарата у пациентов с сопутствующими хроническими лицевыми болями других типов (Obermann, M. Yoon, M. S. 2008).
В открытом перекрёстном исследовании с участием 22 пациентов, получавших лечение по поводу рефрактерной ТН, лечении комбинацией карбамазепина с ламотриджином или прегабалином было показано, что прегабалин обладает сходной с ламотриджином эффективностью и лучше переносится пациентами (Rustagi A. Roychoudhury A. 2014).
В исследовании с участием 61 пациента с рефрактерным к лечению карбамазепином течением тригеминальной невралгии, 33 пациента до проведения хирургического лечения принимали прегабалин. Улучшение отмечалось у 16 пациентов (48,5%) в группе, получавшей прегабалин и ни у одного пациента, не получавшего прегабалина. Средняя доза препарата к окончанию титрации составляла 166,7 мг (наблюдение в среднем составляло 5,5 месяцев). Отмечалась значительно большая эффективность лечения у пожилых пациентов (Hamasaki, T. Yano, S. 2018).
Таблица 1 Выбор дозы габапентина и прегабалина у пациентов с нарушением функции почек
|
Предельный уровень клиренса креатинина |
Максимальная рекомендованная доза
|
|
|
Габапентин1 |
Прегабалин2 |
|
|
30–59 мл/мин |
700 мг х 2 раза в день |
150 мг х 2 раза в день |
|
|
|
100 мг х 3 раза в день |
|
15–29 мл/мин |
700 мг х 1 раз в день |
75 мг х 2 раза в день |
|
|
|
50 мг х 3 раза в день |
|
<15 мл/мин |
300 мг х 1 раз в день |
75 мг х 1 раз в день |
|
Дополнительная доза после гемодиализа |
100–300 мг |
75–150 мг |
Леветирацетам
Предварительные данные пилотного исследования показали эффективность леветирацетама для лечения ТН и незначительное количество нежелательных явлений при приёме препарата (Jorns T. P. Johnston A. 2009). У 4 из 10 пациентов отмечена «значимая тенденция к уменьшению выраженности боли) при приёме препарата в высокой дозе — 3000–5000 мг/сут. В другом открытом неконтролируемом исследовании, леветирацетам 3000–4000 мг/сут назначался в дополнение к препаратам с недостаточной эффективностью (Mitsikostas D. D. Pantes G. V. 2010). Было показано, что приём препарата в течение 16-ти недель снижает среднюю частоту приступов с 9,9 до 3,3 (62,4%, p<0,001) в сутки.
Леветирацетам — противоэпилептический препарат, связывающийся с гликопротеинов синаптических пузырьков 2А (SV2A), что блокирует пресинаптические кальциевые каналы и снижает возбудимость нервных клеток (Vogl C. Mochida S. 2012).
Препарат метаболизируется преимущественно при помощи ферментативного гидролиза в крови и выделяется с мочой почками. При приёме внутрь, пиковая концентрация в плазме достигается через 1 час, время полувыведения — 6–8 часов.
Препарат хорошо переносится, приём сопровождается незначительной частотой нежелательных явлений; требуется осторожность при назначении пациентам с тяжёлой депрессией ввиду возможности ухудшения состояния и появления суицидальных мыслей. Значимых лекарственных взаимодействий при приёме одновременно с другими антиэпилептическими препаратами, включая карбамазепин, не отмечено (Sisodiya, S. M. Sander, J. W. A. S. 2002; Lee, J. W. Dworetzky, B. 2010).
Таблица 2 Выбор дозы леветирацетама у пациентов с нарушением функции почек
|
Клиренс креатинина (мл/мин) |
Суточная доза (мг) |
Обычная доза (х 2 раза в день) |
Максимальная доза (х 2 раза в день |
|
≥80 |
1000–3000 мг |
500 мг |
1500 мг |
|
50 до <80 |
1000–2000 мг |
500 мг |
1000 мг |
|
30 до <50 |
500–1500 мг |
250 мг |
750 мг |
|
<50 |
500–1000 мг |
250 мг |
500 мг |
|
Терминальная хроническая почечная недостаточность |
500–1000 мг |
500 мг однократно |
1000 мг однократно |
|
Дополнительная доза после гемодиализа |
- |
250 мг |
500 мг |
Топирамат
В обзор Wang, Q. P. Bai, M. (2011) были включены данные шести рандомизированных клинических исследований плохого качества. Все исследования были выполнены в Китае, в них приняло участие 354 пациента с тригеминальной невралгией. Результаты мета-анализа показывают, что топирамат был более эффективен чем карбамазепин через 2 месяца приёма (относительный риск (ОР) = 1,2, 95% ДИ 1,04 — 1,39, p=0,01). Однако, не было различий в частоте улучшений на фоне лечения через 1 месяц (ОР = 1,0, 95% ДИ 0,87 — 1,14 p=0,94), частоте ремиссий через 2 месяца приёма препаратов (ОР = 1,31,95% ДИ 0,96–1,8 p=0,09) и частоте нежелательных явлений при сравнении топирамата с карбамазепином.
Сходные результаты были получены в проспективном рандомизированном пакистанском исследовании. Группа из 60-ти пациентов с классической тригеминальной невралгией была случайным образом распределена на 2 равные части для приёма карбамазепина 100 мг х 3 раза в день и топирамата 25 мг х 3 раза в день.
Карбамазепин был более эффективен, чем топирамат через 7 дней с начала лечения, различия в эффективности уменьшались к концу месяца с начала лечения (Wang, Q. P. & Bai, M. 2011).
Использование результатов процитированных исследований ограничивается их низким качеством, связанным прежде всего с небольшим размером выборки.
Фенитоин
Внутривенное введение фенитоина при резком обострении боли (trigeminal neuralgia crisis — серии приступов тригеминальной боли, ограничивающие способность к передвижению, приёму пищи, нарушающие ночной сон, что приводит к дегидратации, сильно выматывает пациентов) оценивалось в ретроспективном когортном исследовании с участием 39 пациентов с тригеминальной невралгией, из них 18 (46,2%) получали инфузии более более одного раза (65 введений). Уменьшение боли отмечалось в 89,2% (58/65), нежелательные явления отмечались у 15,4% (10/65) (Schnell, S. Marrodan, M. 2020).
В описании клинического случая указывается на успешное лечение резистентного к другим препаратам приступа тригеминальной невралгии у 77-летнего пациента, препарат назначался внутривенно в дозе 15 мг/кг (две инфузии с интервалом в 4 часа), значимых нежелательных явлений не было (Tate, R. Rubin, L. M. 2011).
В России в продаже доступен только таблетированный препарат (Дифенин).
Лакосамид
Лакосамид (вимпат) — новый противоэпилептический препарат — избирательно усиливает медленную инактивацию потенциал-зависимых натриевых каналов. Другим возможным механизмом действия препарата является взаимодействие с белком-медиатором ответа на коллапсин 2 (CRMP2).
Эффективность лакосамида для лечения рефрактерных случаев ТН установлено в серии клинических наблюдений. Указывается на отсутствие нежелательных явлений при приёме препарата (Belliston, S. 2019, Masrour, S. 2022).
В ретроспективном исследовании оценивалось 144 эпизода обострения тригеминальной боли у 121 пациента (медиана возраста 61 год, 66,1% женщины). Облегчение боли отмечалось у 77,8% из 63 пациентов, получавших инфузии лакосамида (из них нежелательные явления отмечались у 1,6% пациентов) и у 72,8% из 81 инфузий, нежелательные явления отмечались у 12,3% пациентов, все были небольшой выраженности. Указывается лучшую переносимость лакосамида по сравнению с фенитоином, а также на большую частоту длительных улучшений после введения препарата (Muñoz-Vendrell, A. Teixidor, S. 2022).
В рефрактерных к перечисленным выше препаратам случаев возможно использование препаратов с более скудным обоснованием эффективности: клоназепам, препараты вальпроевой кислоты, опиоидный в низкой дозе — трамадол и морфин, трициклические антидепрессанты.
Таблица 3 Профилактическое лечение болевого синдрома при тригеминальной невралгии
|
Препарат |
Начальная доза |
Повышение дозы* |
Диапазон доз |
Частота приёма |
Снижение дозы |
Характерные нежелательные явления |
Показатели, требующие мониторинга |
|
Карбамазепин |
200 мг/сут |
200 мг каждые 3 дня |
200–1200 мг (у пожилых пациентов — 100 мг/сут — 50 мг х 2 раза в день) |
2–4 раза в день |
200 мг каждые 7 дней |
Головокружения, заторможенность, общая слабость, нарушения координации движений, двоение в глазах, тошнота, замедленность мышления, гипонатриемия, лейкопения, тромбоцитопения, кожные реакции, патологические результаты печёночных проб |
Общий анализ крови, натрий, печёночные пробы, иммунофенотип HLA-B*1502 |
|
Окскарбазепин |
300 мг/сут |
300 мг каждые 3 дня |
300–1800 мг |
4 раза в день |
300 мг каждые 7 дней |
Головокружения, заторможенность, общая слабость, общая слабость, тошнота, нарушения координации движений, гипонатриемия, кожные реакции |
Общий анализ крови, натрий, печёночные пробы, иммунофенотип HLA-B*1502 |
|
Ламотриджин |
25 мг/сут |
25 мг — 2 недели, 50 мг — 1 неделя, затем — повышение дозы на 50 мг еженедельно. |
25–400 мг |
2 раза в день |
50 мг каждые 7 дней |
Головокружения, заторможенность, общая слабость, головная боль, гастроинтестинальные симптомы, раздражительность, нарушения сна, тремор, замедленность мышления, кожная сыпь |
Н/Д |
|
Габапентин |
300 мг/сут |
300 мг каждые 3 дня |
300–3600 мг |
3 раза в день |
300 мг каждые 7 дней |
Головокружение, спутанность сознания, общая слабость, нарушения координации движений, повышенный риск инфекций, гастроинтестинальные симптомы, увеличение массы тела, требуется особое внимание при приёме вместе с опиоидами |
Креатинин* |
|
Прегабалин |
150 мг/сут |
150 мг каждые 7 дней |
150–600 мг |
2 раза в день |
100 мг каждые 7 дней |
Головокружение, спутанность сознания, нарушения координации движений, повышенных риск инфекций, гастроинтестинальные симптомы, увеличение массы тела |
Креатинин* |
|
Баклофен |
15 мг/сут |
15 мг каждые 7 дней |
15–90 мг |
3 раза в день |
15 мг каждые 7 дней |
Спутанность сознания, головокружение, заторможенность, гастроинтестинальные симптомы, эйфория, галлюцинации |
Не требуется |
|
Ботулотоксин тип А |
25–195 ЕД разово |
Н/Д |
25–195 ЕД |
Каждые 12 недель |
Н/Д |
|
Не требуется |
* Препараты выводятся преимущественно почками, функция почек определяет необходимую дозу препарата
Лечение тригеминальной невралгии, как неотложного состояния
В случаях острого начала тригеминальной невралгии с интенсивной боли, рефрактерной к лечению НПВС, или сочетании с жизнеугрожающими состояниями, течение которых осложняется болевым синдромом, требуется быстрый контроль приступов.
Обычное для лечения интенсивных болей назначение опиоидов в данном случае неэффективно.
По данным систематического обзора Moore, D. Chong, M. S. (2019) была показана эффективность следующих групп препаратов:
— местные анестетики (прежде всего, лидокаина — местно на конъюнктиву, слизистую оболочку полости носа или рта, инъекции триггерных точек, внутривенное введение[5], блокада черепных нервов),
— антиконвульсанты — фенитоин или фосфенитоин (внутривенное введение),
— агонисты серотонина — суматриптан (подкожное введение или назально в виде спрея).
Другими вмешательствами с ограниченным доказательствами эффективности были инфузии сульфата магния (обладающего свойствами антагониста NMDA-рецепторов и введение ботулотоксина в триггерные точки.
Отдельным пациентам, для уменьшения воздействия на триггерные точки, требуется регидратация и парентеральное питание (Lambru, G. Zakrzewska, J. 2021).
Блокада тройничного нерва и его ветвей
Было показано, что блокада нервов обеспечивает быстрое купирование боли, которое иногда сохраняется в течение нескольких недель и даже месяцев. Процедура помогает подтвердить связь с вовлечение структур нерва перед более инвазивными вмешательствами, включая хемоденервацию, радиочастотную абляцию и микрососудистую декомпрессию.
Блокада терминальных и поверхностных ветвей тройничного нерва может проводится при помощи анатомических ориентиров и информации, полученной пальпаторной. Каждый из поверхностных нервов выходит из черепа в через соответствующее отверстие, расположенное парасагиттально по зрачковой линии. При проведении инъекции, препарат вводится перед нервов без введения иглы в отверстие. Чтобы исключить попадания местного анестетика в сосуд, перед подачей раствора необходимо потянуть поршень на себя. Для уменьшения болевых ощущений и снижения риск инфекционных осложнений сразу после введения иглы, проводится внутрикожная инфильтрация местным анестетиков (вырезанный иглой кожный цилиндр остаётся под кожей, при развитии воспаления вследствие роста бактерий, оставшихся на коже, очаг будет располагаться поверхностно) (Abd-Elsayed, A. 2021).
Рисунок 3 Места инъекций при поверхностной блокаде тройничного нерва (Abd-Elsayed, A. 2021)
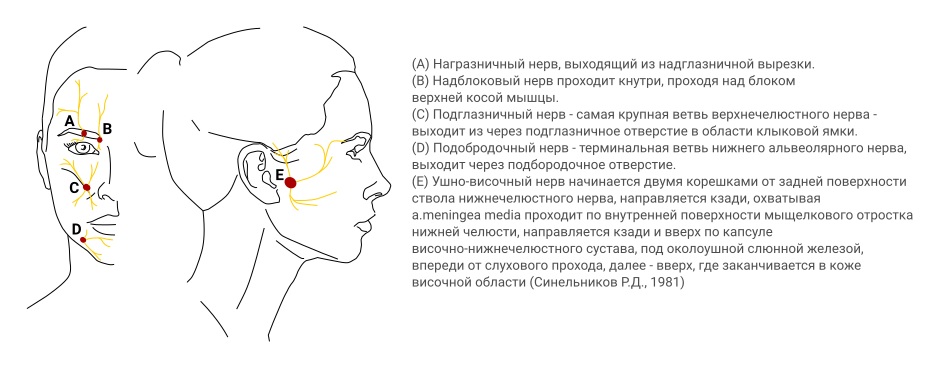
Мишенями при блокаде V1 порции тройничного нерва являются ветви лобного нерва — надглазничный и надблоковый нервы. Надглазничный нерв выходит из полости черепа через надглазничное отверстие, которое располагается на участке между медиальной и наружными двумя третями надглазничного края. Игла вводится чуть ниже нижнего края брови, как ориентир может использоваться нижняя часть мышцы сморщивающей бровь по зрачковой линии, под углом в 45º в краниальном направлении до контакта с костью; после обратного вытягивания иглы на 1–2 мм вводится 0,5 мл анестетика.
Медиальнее этой области, ниже верхнего края глазницы выходит из черепа выходит надблоковый нерв. Область надблокового нерва находится на 1 см ближе к срединной линии от точки надглазничного нерва, также, анатомическим ориентиром является нижнемедиальный края мышцы, сморщивающей бровь.
При блокаде надблокового нерва добиваются парестезии в центральной части лба после вкола у верхнего медиального угла глазницы, где нерв располагается в основании носа на носовой кости. В обоих случаях вводят 1—3 мл местного анестетика (1—1,5% лидокаин, 0,25—0,375% бупивакаин или 0,375—0,75% ропивакаин) с добавлением адреналина (1:200 000) (Зайцев, А. Ю. Светлов, В. А)
Ветвь V2 порции тройничного нерва, подглазничный нерв, можно заблокировать интраоральным и экстраоральным путём. Подглазничное отверстие находится ниже подглазничного края по зрачковой линии на уровне крыльев носа.
Для интраорального доступа, оттягивается щека и игла вводится в слизистую оболочку выше второго верхнего малого коренного зуба (премоляра) и продвигается выше в направлении подглазничного отверстия. Палец обычно размещается в области подглазничного отверстия для контроля положения иглы.
Второй вариант — экстраоральный доступ, может быть обеспечен введением иглы в направлении снаружи кнутри в область подглазничного отверстия (пальпируется нижний глазничный край, от середины которого отступают по 1 см медиально и каудально, игла вводится в направлении к носу на глубину 1–1,5 см, Фишер Ю, 2018), лёгкое массирование области инфекции и лёгкое надавливание пальцем под нижним веком может уменьшить развитие отёка и ограничить распространение анестетика в полость черепа.
Блокада V3 порции тройничного нерва включает инъекции в область подбородочного и ушно-височного нерва. Подбородочное отверстие располагается приблизительно на 1 см ниже второго нижнего малого коренного зуба (премоляра) по зрачковой линии. Также, как подглазничный нерв, блокада подбородочного нерва может быть выполнена из интраорального доступа, когда игла вводится каудально через слизистую щеки в направлении к отверстию.
Ушно-височный нерв располагается поверхностно в проекции височно-нижнечелюстного сустава, может пальпирования в околоушной области. В качестве анатомического ориентира может использоваться височная артерия, которая идёт по направлению к козелку. При проведении блокады ушно-височного нерва, игла вводится кпереди от артерии. Вблизи от козелка находится лицевой нерв, с чем связана возможность развития преходящего прозопареза.
Ввиду близости сосудов к областям блокады проксимальных отделов ветвей тройничного нерва, при введении иглы рекомендуется регулярно проводить потягивание поршня шприца на себя. Пациенты могут испытывать парестезии в области иннервации верхне — и нижнечелюстного нервов, что указывает на верное положение иглы.
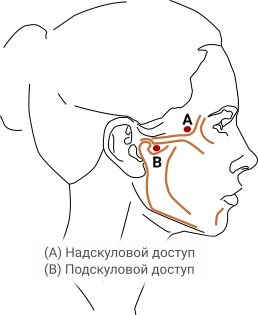
Верхнечелюстной нерв выходит из через круглое отверстие, минуя крылонебную ямку через нижнюю глазничную щель, проходит в глазницу и далее через подглазничное отверстие выходит на переднюю поверхность лица. Блокада нерва может осуществляться как подскуловым (по Braun (1905), в модификации С. Н. Вайсблата), так и надскуловым (околорбитальным/окологлазничным по Войно-Ясеневскому).
При использовании окологлазничного метода по Войно-Ясеневскому точкой вкола иглы является угол, который располагается на пересечении вертикальной линии от латеральной стенки глазницы и горизонтальной линии скуловой дуги. Иглу направляют строго перпендикулярно до соприкосновения с латеральной стенкой глазницы (1—3 см) [1], затем по среднекаудальной оси на угол рта на стороне пункции на глубину от 2 до 6 см, таким образом чтобы игла постоянно тесно контактировала с костью. Вводят 2—5 мл местного анестетика (в среднем 0,1 мл ∙ кг-1) (Зайцев, А. Ю. Светлов, В. А. 2012).
Нижнечелюстной нерв покидает полость черепа через овальное отверстие в подвисочной ямке, где располагается кнаружи от латеральной крыловидной мышцы и кнутри от хрящевой части евстахиевой трубы. Овальное отверстие, как правило, находится на одной сагиттальной линии с крыловидным отростком верхней челюсти или несколько латеральнее.
Официальных руководств по инъекционной терапии не существует. По причине относительно небольшого количества пациентов, получающих лечение каждой из альтернативных методик, проведение рандомизированных клинических исследований крайне сложно. Оценка эффективности такого лечения нарушается естественным течением тригеминальной невралгии с продолжительными периодами спонтанной ремиссии. На практике конкретный метод лечения выбирается индивидуально.
Рисунок 4 Места введения иглы при блокаде верхнечелюстного и нижнечелюстного нервов (Abd-Elsayed, A. 2021)
Денервация действием нейротоксинов
Была установлена эффективность ботулотоксина в лечении невропатической боли.
Ботулинический нейротоксин — группа белков, которые вырабатываются анаэробными бактериями Clostridium botulinum, включащими около 40 подтипов, на основании антигенной структуры выделяется 7 серотипов, наиболее часто в качестве лекарственных препаратов используются ботулотоксин A и ботулотоксин B.
Механизм действия ботулотоксина для лечения невропатической боли связан с блокадой потенциал-зависимых натриевых каналов (Dubner, R. Yang, K. Y. 2016). Предполагается аксональный транспорт ботулотоксина из периферических окончаний нервов к телу нейрона. Центральный механизм действия ботулотоксина подтверждается двусторонним эффектом при одностороннем введении препарата, однако, при исследовании с радиоактивными метками, было установлено, что весь препарат остаётся после введения на стороне инъекции (Park J. Park H. J. 2017).
Ботулотоксин блокирует высвобождение болевых медиаторов, включая субстанцию P и пептид, связанный с геном кальцитонина (CGRP), уменьшает выраженность воспаления вокруг корешков нервов. У пациентов с ТН, отвечающих на лечение ботулотоксином А отмечается снижение плазменной концентрации CGRP, в то время как у лиц с неэффективностью лечения этих изменений не отмечалось.
Разрушение мембранного белка SNAP-25 (мембранный белок, который в составе белкового комплекса SNARE, осуществляет стыковку синаптической везикулы с пресинаптической мембраной нейрона и их слияние с последующим высвобождением нейромедиатора.
Рисунок 5 Механизм обезболивающего действия ботулинического нейротоксина
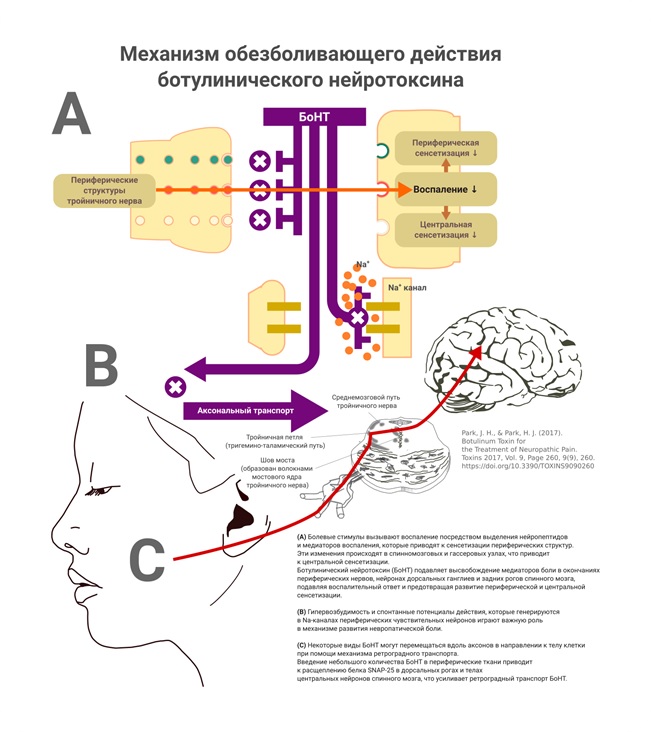
Действие ботулотоксина приводит к инактивации каналов с транзиторным рецепторным потенциалом — ванилоидный[6] рецептор 1 (TRPV1) и аникриновый рецептор 1 (TRPA1).
Инъекционная терапия ботулотоксином является безопасным и эффективным методом лечения тригеминальной невралгии. Различий между дозами ботулотоксина А не выявлено. Максимальная эффективность лечения отмечалась в сроки от 6-ти недель до 3-х месяцев после введения препарата. Нежелательные явления были представлены прежде всего асимметрией лица после инъекций, головными болями, кровоизлияниями в местах инъекций (исчезали через неделю).
Мета-анализ исследований использования ботулотоксина А (БТ-А) для лечения ТН (Rubis, A. Juodzbalys, G. 2020) включал результаты 4-х рандомизированных двойных слепых плацебо-контролируемых исследований с продолжительностью наблюдений от 8 до 12 недель, направленных на оценку изменений оценок ВАШ и частоты приступов ТН, различия между дозами ботулотоксина В и нежелательными эффектами. В среднем после инъекций в группах, получавших лечение БТ-А, отмечалось снижение оценки по ВАШ приблизительно на 68%, а в группе плацебо — на 21,6%. Средняя частота приступов по данным 3-х исследований в группах БТ-А снижалась на 85%, в то время, как введение плацебо, вызывало уменьшение только на 15,9%.
Хирургическое лечение тригеминальной невралгии
Возможность хирургического лечения рассматривается в случае неэффективности или непереносимости медикаментозного лечения, что отмечается у 25–50% пациентов (Abd-Elsayed, A. 2021). Общепризнанного мнения о том, сколько вариантов медикаментозного лечения должно быть опробовано до направления пациентов на операцию, не существует.
Микрососудистая декомпрессия
Тригеминальная невралгия, ввиду своей тяжести, одно из первых заболеваний, в отношении которого стало использоваться нейрохирургическое лечение. В начале 20-го века хирургическое лечение тригеминальной невралгии сопровождалось существенной частотой осложнений и даже, летальных исходов, несмотря на это, по причине тяжёлого и прогрессирующего заболевания, многие пациенты предпочитали его лечению медикаментами.
Несмотря на то, что консервативное лечение является методом выбора, в рефрактерных случаях ТН рекомендуется нейрохирургическое лечение, включая микрососудистую декомпрессию (МСД), чрескожные или радиохирургические вмешательства. МСД обеспечивает непосредственную и долговременную эффективность в 68–90% случаев.
Микрососудистая декомпрессия нерва является наиболее эффективным методом лечения невралгии тройничного нерва, однако, её проведение сопровождается риском осложнений: длительное истечение спинномозговой жидкости, онемение лица, снижение слуха, раневая инфекция и инсульт, в связи с этим, проведение вмешательства рекомендуется лишь в специализированных центрах с низкой долей осложнений.
В связи с этим разрабатываются новые техники и инструменты лечения, обладающие большей эффективностью и безопасностью. Выделено несколько характеристик пациентов, которые можно использовать для прогноза вмешательства (Burchiel, K. J. 2003), однако, для оценки их значимости нужны более длительные наблюдения (Chen, Q. Yi, D. I. 2022).
Микроваскулярная декомпрессия, по причине инвазивности, часто используется для лечения молодых пациентов.
Таблица 4 Классификация лицевой боли по Burchiel
|
Спонтанное начало |
|
|
ТН 1 типа |
>50% эпизодическая боль, острая, стреляющая, похожая на удар электрическим током |
|
ТН 2 типа[7] |
>50% постоянная ноющая, пульсирующая боль, ощущение жжения |
|
Повреждение тройничного нерва |
|
|
Тригеминальная невропатическая боль |
Непреднамеренная, случайная травма |
|
Тригеминальная деафферентационная боль |
Спланированная деафферентация |
|
Симптоматическая ТН |
Рассеянный склероз |
|
Постгерпетическая невралгия |
Обострение тригеминальной невралгии, вызванной вирусом опоясывающего герпеса |
|
Атипичная лицевая боль |
Соматоформное болевое расстройство |
Нейроаблятивное лечение
Процедуры относятся к «малой хирургии», и за исключением радиотерапии, проводятся под внутривенной анестезией короткодействующими препаратами, такими как пропофол. Проводится мониторинг жизненно важных показателей: пульсоксиметрия, электрокардиограмма и артериальное давление.
Чтобы обеспечивать правильное положение инструмента, подводящего разрушающий агент (иглы), используется флюороскопия при помощи С-дуги, реже — компьютерной томографии или ультразвуковых методов. Верность положения инструментов оценивается на основании сенсорного и моторного ответов на стимуляцию прилежащих структур.
Чрезкожные трансоовальные игольчатые техники
Радиочастотная термоабляция
Повреждение структур тройничного нерва при воздействии неионизированного электромагнитного излучения (электро-магнитный генератор и биполярные электроды), вызывающего колебательное движение ионов и локальное нагревание тканей до 70ºС. В течение нескольких минут в зоне воздействия развивается некроз.
Чрезкожная баллонная компрессия
Действие метода (Mullan S, Lichtor T. 1983) основано на использовании баллонного катетера, увеличение концевой части которого при введении контрастного вещества, наносит структурные повреждения прилегающим частям тройничного нерва, нарушая их способность проводить болевые импульсы
Ризолиз глицерином или этиловым спиртом
После введения иглы, вводится 0,1 мл йодсодержащего контрастного вещества, положение которого оценивается флюороскопически. Для исключения инъекции сосуда используется цифровая субтракционная ангиография. Вводится 0,25–3,0 мл 99,9% глицерина или 70% спирта, после чего, игла медленное извлекается.
Для снижения риска осложнений пациента рекомендуется оставить в положении сидя с согнутой головой. Рекомендуется наблюдение пациента для исключения подтекания спинномозговой жидкости и других осложнений. Облегчение болей отмечается в течение нескольких часов после манипуляции.
Внутренний невролиз
Это процедура разделения волокон тройничного нерва на участке между варолиевым мостом и тройничным отверстием — porus trigeminus (отверстие в твёрдой мозговой оболочке у входа в тройничную полость — cavum trigeminale, меккелева полость) для облегчения тригеминальной невралгии.
Процедура считается потенциально эффективной и безопасной для лечения рефрактерных случаев ТН. Несмотря на обнадёживающие предварительные результаты, данные отдалённых наблюдений недоступны.
Стереотаксическая радиотерапия (гамма-нож)
Для нарушения функции тройничного нерва используется одиночный 4 мм изоцентр (порция радиации) проксимальной части непосредственно в месте выхода нерва из варолиева моста.
Неинвазивность является преимуществом метода ввиду отсутствия риска подтекания СМЖ, инфекционных и геморрагических осложнений, однако, частота осложнений, связанных с повреждением черепных нервов и нарушением их функций, сравнима с другими методами лечения.
Нередко, метод используется для лечения пациентов, у которых были неэффективны другие методы хирургического лечения.
Таблица 5 Эффективность и безопасность хирургических вмешательств при тригеминальной невралгии (Lambru, G. Zakrzewska, J. 2021)
|
Вмешательство |
Микрососудистая декомпрессия |
Стереотаксическая радиохирургия |
Радиочастотная термоабляция |
Баллонная компрессия |
Ризолиз глицерином |
Внутренний невролиз |
|
|
Эффективность |
|||||
|
Количество исследований |
21 |
8 |
7 |
5 |
3 |
1 |
|
Общее количество участников |
5149 |
1168 |
4533 |
755 |
289 |
26 |
|
Средняя/медиана продолжительности наблюдения (лет) |
3–10,9 |
3,1–5,6 |
3–9,3 |
4,2–10,7 |
4,5–8 |
3,6 |
|
Продолжительность безболевого периода во время наблюдения |
62–89% |
30–66% |
26–82% |
55–80% |
19–58% |
72% |
|
|
Безопасность |
|||||
|
Изменения чувствительности лица (%) |
3 |
16 |
19 |
15 |
40 |
96 |
|
Гипестезия роговицы (%) |
0,3 |
0 |
6,6 |
0,7 |
6,6 |
0 |
|
Потеря слуха (%) |
1,8 |
0 |
0,1 |
0 |
0,3 |
0 |
|
Нарушения двигательных функций (%) |
0 |
0 |
6,2 |
4,5 |
1,7 |
0 |
|
Парезы черепных нервов (%) |
4,1 |
0,2 |
0,8 |
1,6 |
0 |
0 |
|
Менингит |
0,4 |
0 |
0,02 |
5,7 |
0 |
0 |
|
Подтекание СМЖ |
2 |
0 |
0,1 |
0 |
0 |
3,8 |
|
Болезненная анестезия |
0,2 |
0 |
0,6 |
0,1 |
0,7 |
3,9 |
|
Летальность |
0,3 |
0 |
0 |
0 |
0 |
0 |
Болезненные тригеминальные невропатии (V)
Болезненная тригеминальная невропатия, связанная с течением инфекции вируса опоясывающего герпеса
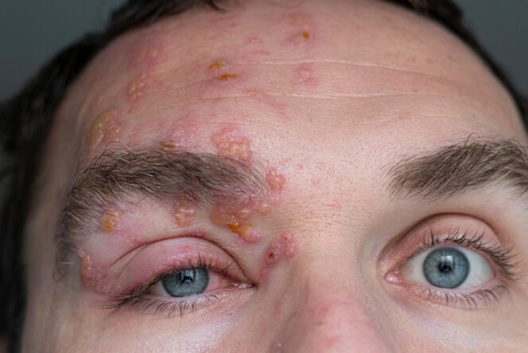
Рисунок 6 Пузырьковые высыпания, вызванные поражением I ветви тройничного нерва (n.ophthalmicus) вирусом опоясывающего герпеса
Источник: https://myvision.org/eye-conditions/shingles-on-face/
Болезненной тригеминальной невропатией, связанной с течением вируса опоясывающего герпеса называют одностороннюю лицевую боль, которая сохраняется менее трёх месяцев с момента появления симптомов вовлечения одной и более ветвей тройничного нерва, вызванных вирусом опоясывающего герпеса и/или сопровождающихся классическими симптомами вирусами опоясывающего герпеса.
Вовлечение Гассерова узла отмечается в 10–15% случаев инфекций, вызванных вирусом опоясывающего герпеса (H.zoster). В большинстве случаев (до 80%) вовлекается I ветвь тройничного нерва. В редких случаях боль возникает без предшествующих герпетических высыпаний. В этом случае причинная роль герпетической инфекции подтверждается выявлением ДНК вируса в ликворе при помощи полимеразной цепной реакции. Поскольку в большинстве случаев, симптомы заболевания ограничены и легко контролируются, оснований рутинного обследования пациентов с подозрением на герпетическую природу невропатической боли не требуется.
Герпетическая инфекция (H.zoster) часто развивается у пожилых и пациентов с иммунодефицитными состояниями.
Постгерпетическая тригеминальная невралгия
Постгерпетической невралгией считается боль, которая сохраняется или рецидивирует 3 и более месяцев после появления герпетических высыпаний.
Болезненная посттравматическая тригеминальная невропатия
Травматическое воздействие может быть механическим, химическим, температурным или вызванным ионизирующей радиацией. Процедуры абляции корешка и узла тройничного нерва могут вызывать невропатическую боль, вовлекающую одну и более ветвей, она тоже должна рассматриваться как посттравматическая и включаться в данную категорию.
Глазная невропатическая боль
«Глазная невропатическая боль» — диагноз исключения, предназначенный для случаев с повышенной болевой чувствительностью, развитием боли в ответ на неболевые стимулы. В большинстве случаев у пациентов при объективном осмотре не выявляется каких-либо нарушений — боль в роговице без причины — это глазной аналог комплексного регионального болевого синдрома, системной невропатической боли или рефлекторной симпатической дистрофии.
Патогенез глазной невропатической боли тесно связан с сенситизацией структур болевой чувствительности глаза.
По причине сложности механизмов глазной невропатической боли, жалобы пациентов с дизестезией могут существенно отличаться. Пациенты описывают ощущение жжения, покалывания, сверлящей боли, ощущения инородного тела или раскалённой кочерги в глазу, светобоязнь. Хроническая гиперактивность ноцицепторов может вызывать блефароспазм.
Состояние имеет много общего с синдромом «сухого глаза». Отсутствие уникальных клинических признаков обрекает многих пациентов на суждение о симуляции или диагноз соматизированного заболевания. В связи с этим, значимым первым шагом для лечения является убедить пациента в реальности и объективности его боли.
Актуальность глазной невропатической боли подчёркивают выраженное функциональное значение симптома и случаи тяжёлого течения с суицидальными попытками пациентов (Moshirfar, M. Benstead, 2023).
Паратригеминальный окулосимпатический синдром (синдром Редера, болезненный синдром Горнера)
Односторонняя боль постоянного характера, распределяется в офтальмической ветви тройничного нерва, иногда, распространяется в верхнечелюстную ветвь, усиливается при движении глаз, сопровождается синдромом Горнера на той же стороне. Причиной является патология средней черепной ямки или сонной артерии (боль развивается параллельно с патологией).
Синдром жжения полости рта (Burning mouth syndrome)
Развитие синдрома жжения полости рта связывается с сенсорной невропатией с вовлечением тонких волокон тройничного нерва (Lauria G. Majorana A. 2005), при этом, в исследованиях было показано увеличение количества свободных дофаминовых рецепторов в скорлупе (Wood P. B. 2008); есть описание клинического случая эффективности прамипексола для лечения этого состояния (Stuginski-Barbosa J. Rodrigues G. G. R. 2008). Остальные лекарственные препараты, эффективные при лечении синдрома были сходные с наборами средств для лечения ТН (Abd-Elsayed, A. 2021).
Невропатия промежуточной части лицевого нерва (V)
Болезненная невропатия промежуточного нерва (n. Intermedius, нёбноязычный нерв, нерв Врисберга, нерв Саполини).
Выходит из мозга самостоятельным стволом между лицевым и преддверно-улитковым нервами. Содержит вегетативные и вкусовые волокна. Присоединяется к лицевому нерву внутри пирамиды височной кости (Фениш Х. «Карманный атлас анатомии человека». )
Боль распространяется в области слухового канала, наружного уха или сосцевидного отростка.
При невропатии обычно описывается пациентами как тупая, глубоко в ухе, постоянная или сохраняющаяся большую часть времени. На фоне боли с такими характеристиками могут возникать кратковременные приступы более интенсивной боли, но они не являются ведущей клинической характеристикой состояния.
При невралгии — возникают кратковременные приступы боли в той же области распределения.
Поражения промежуточного нерва обычно не вызывают выраженных нарушений чувствительности, пациенты могут отмечать онемение кожи наружного слухового прохода, ушной раковины или области сосцевидного отростка.
В литературном обзоре статей PubMed, опубликованных до февраля 2020, было выявлено всего 102 случая, средний возраст которых составил 44,8 лет, преимущественно — женщины (Robblee J. 2021). 48,0% случаев было вызвано нейроваскулярным конфликтом, 10,8% было связано с инфекциями, чаще — синдром Рамсея Ханта и хронический средний отит, среди других предрасполагающих факторов были объёмные образования, миелит, утолщения и спайки паутинной оболочки или ятрогенные причины. Остальные 10,8% расматривались, как идиопатические.
Невралгия языкоглоточного нерва (IX)
Ранее использовался термин вагоглоссофарингеальная невралгия, синдром Сикара.
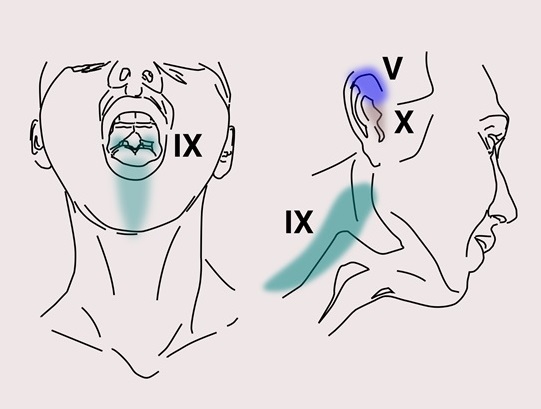
Расстройство характеризуется односторонней кратковременной кинжальной боли с внезапным началом и окончанием. Она распространяется не только в области иннервации языкоглоточного нерва, но и ушной и глоточной ветвей тройничного нервов. Боль захватывает ухо, корень языка, область миндаликовой пазухи и/или область ниже угла нижней челюсти. Приступы часто возникают при жевании, глотании, речи, зевоте или кашле.
Приступы боли иногда сопровождаются синкопальным состоянием, что связывается с раздражением депрессорного нерва (nervus depressor nervi vagi; синонимы. аортальный нерв, нерв Циона — Людвига).
Для течения заболевания характерна смена обострений и ремиссий, как при тригеминальной невралгии.
Диагностические критерии
- Повторные приступы односторонней боли в зоне иннервации языкоглоточного нерва и соответствующие критерию В
- Боль обладает всеми нижеперечисленными характеристиками
- Продолжается от нескольких секунд до 2-х минут
- Выраженная интенсивность
- Простреливающая острая боль, сходная с ощущением от удара электрическим током
- Провоцируется глотанием, кашлем, разговором или жеванием
- Не имеет лучшего объяснения другим состоянием, описанным в МКГБ-3
Рисунок 7 Область иннервации ушной и глоточной ветви тройничного нерва (V), языкоглоточного (IX) и блуждающего нервов (X)
Невралгия затылочного нерва
Односторонняя или двусторонняя пароксизмальная простреливающая или пульсирующая боль сзади волосистой части головы.
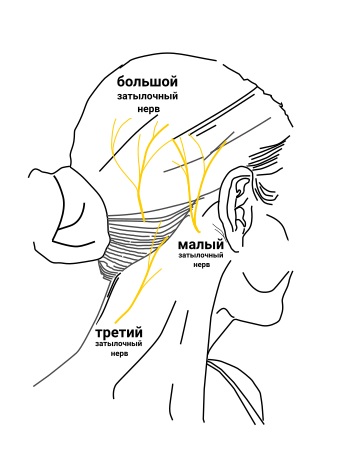
Боль в области распределения большого (до 90%), малого или третьего (непостоянная анатомическая структура) затылочного нерва, иногда сочетается с нарушением чувствительности или дизестезией поражённой области. Часто в области выхода вовлечённого нерва отмечается болезненность.
Анатомические связи спинальных и черепных нервов объясняют развитие лицевых болей при первичном поражении затылочных нервов.
Рисунок 8 Анатомия затылочных нервов
Трегеминоцервикальные интернейрональные связи
Афферентные волокна шейных корешков и тройничного нерва несут информацию с соседних областей головы и их конвергенция на нейронах задних рогов шейных сегментов является потенциальным субстратом отражённой боли при первичной головной боли: спинальный нерв C2 и тройничный нерв иннервируют смежные области головы, вовлечённые в клинические проявления первичных головных болей — головной боли напряжения, мигрени или кластерной головной боли. Проводники болевой чувствительности C2, несущие информацию от затылочной области и шеи, оканчиваются в задних рогах сегментов C1–3 спинного мозга; в свою очередь проводники болевой чувствительности тройничного нерва, иннервирующие переднюю часть лица (кожу лица, твёрдую мозговую оболочку или кровеносные сосуды), входят в ствол мозга на уровне варолиева моста и заканчиваются на клетках ядра спинального пути тройничного нерва и клетках задних рогов спинного мозга на уровне верхних шейных сегментов.
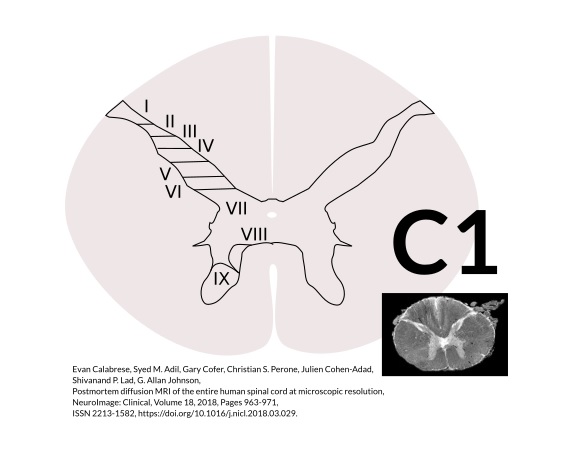
Центральными нейронами этого механизма являются нейроны I пластины по Рекседу, они передают импульсы после их конвергенции в супраспинальные центры болевой чувствительности. В лабораторном исследовании Fernandes EC, Carlos-Ferreira J, 2022 было показано взаимодействие цервикальных и тригеминальных афферентов посредством механизма пресинаптического торможения, в котором импульсы, поступающие на нейроны I пластинки подвергаются одностороннему или реципрокному контролю по действием пресинаптических связей с интернейронами задних рогов спинного мозга. Высвобождением ГАМК из окончаний вставочных нейронов (интернейронов) блокирует возникновение потенциалов действия или уменьшает их амплитуду.
Рисунок 9 Слои (пластины) серого вещества спинного мозга по Рекседу
Невропатии и невриты с вовлечением зрительного нерва (II)
Неврит зрительного нерва
Невритом зрительного нерва обозначают его воспалительное поражение в связи с различными причинами, включая рассеянный склероз, расстройства спектра оптикомиелита, расстройства, ассоциированные с антителами к миелин-олигодендроцитарному гликопротеину (MOGAD), острый диссеминированный энцефаломиелит (ADEM) и другие аутоиммунные заболевания. Клинические проявления неврита зрительного нерва вариабельны. До 50% пациентов жалуются на острое развитие интенсивной боли в периорбитальной и лобно-височной области за несколько дней до развития зрительных нарушений.
Ишемическая невропатия зрительного нерва
Это одна из основных причин слепоты или выраженного нарушения зрения, однако, существует неопределённость в отношении патогенеза, клинических особенностей и лечения пациентов с данным состоянием.
Причиной этому является то, что ишемическая невропатия зрительного нерва не единое заболевание, а несколько различных типов со своей этиологией, патогенезом, клиническими характеристиками и ведением.
Выделяется два основных типа — передняя (AION) и задняя (PION), поражение диска зрительного нерва и остальной части нерва соответственно. В AION и PION выделяются различные субтипы. AION включает поражения, вызванные артериитом (A-AION — вызванную гигантоклеточным артериитом) и другого происхождения, не связанные с гигантоклеточным артериитом — NA-AION; NA-AION в свою очередь подразделяется на классическую NA-PION и угрожающую NA-AION. PION состоит из поражений, вызванных артериитом (A-PION) и другими причинами (NA-PION), а также «хирургического» (осложнение отдельных хирургических вмешательств). Таким образом, выделяется 6 различных типов ишемической невропатии зрительного нерва. NA-AION — наиболее распространённая и значимая для развития нарушений зрения форма у лиц среднего возраста и пожилых.
Оценки распространённости боли при AION сильно различаются, и находятся в пределах от 12 (Swartz N. G. Beck R. W. 1995) до 92,2%.
Учитывая то, что основным симптомом неврита зрительного нерва являются зрительные нарушения, диагностика причин лицевой боли, сопутствующей данному состоянию не представляет затруднений.
Невропатии и невриты с вовлечением глазодвигательных нервов (III, IV, IV)
Ишемическая невропатия глазодвигательных нервов
Боль основной признак микрососудистого ишемического поражения глазодвигательных нервов. Развитие ишемического поражения глазодвигательных нервов часто ассоциировано с сахарным диабетом, при этом, данные случае не имеют специфических клинических проявлений. Боль может как предшествовать развитию явных глазодвигательных нарушений, так и развиваться одновременно с ними.
Синдром Толосы-Ханта
Синдром Толосы-Ханта (болезненная офтальмоплегия) — сочетание нарушения функции одного или нескольких черепных, чаще — глазодвигательных, нервов с болевым синдромом интра — или экстраорбитальной локализации. Возможно и вовлечение I ветви тройничного нерва.
Большинство случаев, синдрома Толоса-Ханта не имеет явной причины (идиопатический), их объединяет только общий механизм — воспаление в области кавернозного синуса и/или верхней глазничной щели. Для воспалительного процесса характерна инфильтрация лимфоцитами и плазматическими клетками с последующей пролиферацией фибробластов и утолщением твёрдой мозговой оболочки.
Более редкие причины состояний с клиникой синдрома Толосы-Ханта — травмы, опухоли или аневризмы.
Для заболевания характерно рецидивирующее течение.
Это редкое заболевание, признанное National Organisation for Rare Disorders (NORD)[8], расчётная заболеваемость составляет около 1 случая на 1 млн населения в год. Чаще страдают молодые люди, географических и расовых различий заболеваемости не выявлено.
Рецидивирующая болезненная офтальмоплегическая невропатия
Ранее состояние некорректно обозначалось термином «офтальмоплегическая мигрень»
Рецидивирующая болезненная офтальмоплегическая невропатия (РБОН) относится к редким заболеваниям. Предполагаемая распространенность составляет около 0,7 случая на 1 млн (данные Hansen c соавт. 1990, полученные при изучении населения округа Копенгагена, более поздние эпидемиологические исследования не проводились), в связи с чем, диагностика данного состояния проводится методом исключения других, более распространённых.
Повторные эпизоды развития пареза одного или более черепных нервов (чаще глазодвигательных III) c односторонней головной болью (боль может развиваться за срок до 14 дней до развития глазодвигательных нарушений)
Для постановки диагноза, необходимо наличие не менее двух приступов, соответствующих следующим характеристикам: односторонняя головная боль в сочетании с парезом одного, двух или трёх глазодвигательных нервов на той же стороне.
Вторичная природа боли должна быть надёжно исключена, а состояние не должно иметь лучшего объяснения другими формами лицевой боли. МРТ с контрастным усилением может выявлять накопление контраста или утолщение нервов. Примечательна регистрация во время приступов электроэнцефалографических признаков приступов мигрени с аурой/осложнённых приступов мигрени (Maggioni F, Briani C, 2012), на момент проведения исследования действовала МКГБ-2, в которой РБОН не связывалась с мигренью.
Было предложено несколько гипотез, объясняющих развитие рецидивирующей болезненной офтальмоплегической невропатии, включая ишемию или воспаление/демиелинизацию нерва, однако ни одна из них не является общепризнанной.
У части пациентов эффективно лечение кортикостероидами.
Общие принципы ведения пациентов с лицевыми болями
Обследование
Появление доступных методов инструментальной диагностики не снизило ценности сбора жалоб и анамнеза, объективного обследования пациента, включая неврологический осмотр. Клинический диагноз, поставленный до обширного обследования пациента, позволяет помочь пациенту полнее, быстрее и дешевле. Алгоритмизация обследования и лечения таких пациентов позволяет снизить зависимость качества помощи от личных качеств и функционального состояния врача.
Автор публикации считает одной из основных характеристик врача или медицинского коллектива отсутствие привычки делать лишние исследования.
Ниже приводится перевод таблицы с основными данными объективного обследования, которые используются при постановке диагноза типа лицевой боли.
Таблица 6 Оценка пациента с лицевой болью при первичном обращении
Deun, Laura & Witte, Muriel & Goessens, 2020
|
Анамнез |
|
|
Характеристики пациента |
Возраст, пол, раса, сопутствующие заболевания |
|
Характеристики боли |
Временные характеристики (периодичность и продолжительность) Локализация и распространением Качество и тяжесть Факторы, усиливающие или облегчающие боль, например, сон Влияние на повседневную жизнь пациента |
|
Сопутствующие симптомы и состояния |
Головная боль и/или мигренозные признаки Неврологические нарушения Симптомы поражения ЛОР-органов Симптомы поражения глаз Симптомы поражения височно-нижнечелюстных суставов Системные симптомы Состояния, сопровождающиеся хронической болью |
|
Объективный статус |
|
|
Общий и неврологический осмотр |
Полный неврологический осмотр, исследование глазного дна Обследование горла, носа, ушей и глаз, включая пальпацию блоковой ямки Пальпация области височно-нижнечелюстных суставов Внешняя оценка и пальпация области височных артерий Оценка шейного отдела позвоночника с исследованием объёма движений |
Объективный осмотр
Объективный осмотр пациента с лицевой болью должен включать оценку позы, прежде всего положение головы и шеи, подвижности в шейном отделе позвоночника, тонус и болезненность паравертебральных мышц и мышц плечевого пояса. Типичными местами расположения триггерных точек при цервикогенной головной боли, которая может вовлекать и лицо пациента являются области ремённых мышц головы (mm.plenius capitis) на стороне боли, середина верхнего края трапециевидной мышцы, ромбовидная мышца на стороне боли.
Оценивается нижняя челюсть: амплитуду и симметричность движений, реакция на пальпацию жевательных мышц и областей височно-нижнечелюстного сустава, суставной шум (субъективно — по заявлению пациента, и объективно), прикус.
Необходим осмотр ушных раковин, областей сосцевидных отростков, при наличии возможности — наружного слухового прохода (ушная воронка + отоскоп).
Необходима общесоматическая оценка пациента — активность, цвет и влажность кожных покровов, периферические отёки (при их наличии — локализация), признаки системных заболеваний: сыпь (характер, локализация, динамика — анамнестически), клинико-анамнестические признаки суставного синдрома, висцеральные признаки хронических воспалительных заболеваний: гепато — и спленомегалия.
Неврологический осмотр
Несмотря на исключительную редкость менингеального происхождения головной и лицевой боли, часто более выраженной общемозговой симптоматики у пациентов с менингитами и внутричерепными кровоизлияниями, оценка менингеальных знаков (не только ригидности мышц затылка, но и симптом Кернига) обязательна для оценки пациентов с лицевой и головной болью.
Для исключения компрессионного и иного поражения глазодвигательных нервов — показана оценка глазодвигательных функций. Анализ их нарушений позволяет исключить центральные (стволовые) причины поражения.
Снижение или выпадение чувствительности более характерно для пациентов с вторичной ТН.
Наличие и живость тригеминальных рефлексов может использоваться для оценки всех областей, которые иннервируются тройничным нервом.
В клинической оценке пациентов с лицевыми болями указывается на важную роль тригеминальных рефлексов — нормальных непроизвольных ответов, сохранность которых указывает на сохранность структур тройничного нерва. К ним относятся корнеальный и мигательный (тригеминофациальные) рефлексы — мигание в ответ на прикосновение к роговице или приближении предмета к глазу/действии яркого света соответственно, слёзный рефлекс (тройничный и промежуточная порция лицевого нерва), рефлекс, жевательный (»бульдожий») рефлекс — резкое повышение тонуса жевательных мышц при лёгком постукивании по пальцу исследователя, плотно прижатого горизонтально между нижней губой и подбородком при приоткрытом рте, тригеминоцервикальный рефлекс — повышение тонуса грудино-ключично-сосцевидной мышцы при нанесении раздражения в область иннервации супраорбитального нерва (оценивается электрофизиологически) (Bogdanova, V. R. 2015).
Исследование тригеминальных рефлексов, в том числе с использованием электрофизиологических методов, рассматривается как альтернативный способ отличить случаи первичной и вторичной тригеминальной невралгии у пациентов с противопоказаниями к МРТ головного мозга (Bendtsen, L. Zakrzewska, J. M. 2019).
Инструментальные исследования
Использование инструментальных методов исследования позволяет сузить круг состояний дифференциально диагностического поиска.
Наиболее частыми структурными изменениями у пациентов с клиникой поражения черепных нервов являются
- признаки воспалительного/демиелинизирующего поражения нервных стволов, реже областей расположения чувствительных ядер и хода интрацеребральных порций в стволе мозга
- признаки воспалительных заболеваний структур лицевого черепа — придаточных пазух носа, структур среднего и внутреннего уха
- признаки сдавления черепных нервов сосудистыми структурами (петли, аневризмы) и/или внутричерепными объёмными образованиями, включая изменённые оболочки мозга
В связи с этим, для обследования пациентов с клиникой краниальных невропатией, рекомендуется проведение 3D T2 методик МРТ головы с высокой разрешающей способностью: ускоренная спин-эхо с равновесным углом 90º — FRFSE (GE), Driven Equilibrium FSE (Hitachi), DRIVE (Philips), RESTORE (Siemens), FSE T2 pulse (Toshiba), истиная FISP (TrueFISP) когерентная техника, использующая полный сбалансированный градиентный сигнал CISS (Siemens), FIESTA (GE). Данные режимы обеспечивают превосходную контрастность цереброспинальной жидкости — яркий гиперинтенсивный сигнал и нейрососудистыми структурами — гипоинтенсивный сигнал. К недостаткам последовательностей относится недостаточно выраженные различия артерий и вен, сосудов и нервов между собой или с паренхимой мозга. Последовательности времяпролетной, или приточной МР-ангиографии — 3D ToF (time of flight) обеспечивают хорошую визуализацию артерий — гиперинтенсивный сигнал, достаточно контрастную с цереброспинальной жидкостью — гипоинтенсивный сигнал. Данная последовательность визуализирует черепные нервы, однако различить их их сложно ввиду промежуточной интенсивности сигнала.
Визуализация вен значительно хуже ввиду низкой скорости кровотока в них.
Аппараты с индукцией магнитного поля 3 Тл, вероятно, предпочтительнее, чем 1,5 Тл. Рекомендуется использовать тонкие срезы. При описании полученных результатов требуется описывать морфологические изменения нервов в местах контакта с сосудом. Для уменьшения риск ошибочных суждений, специалист по лучевой диагностике не должен располагать информацией о стороне распространения боли.
Пациентам с противопоказаниями к МРТ головного мозга проводится КТ головы, исследование может быть дополнено КТ-ангиографией церебральных артерий (с использованием йодсодержащего контраста). Исследование значительно менее информативно, чем МРТ.
Дополнительными методами исследования являются тригеминальные вызванные потенциалы и электрофизиологические оценки эффектов тригеминальных рефлексов.
Дифференциальный диагноз лицевых и головных болей
Общие с тригеминальной невралгией признаки могут иметь многие головные боли, а также другие состояния, вовлекающие структуры лица — придаточные пазухи носа, височно-нижнечелюстной сустав.
Таблица 7 Дифференциальный диагноз тригеминальной невралгии (Lambru, G. Zakrzewska, J. 2021)
|
Стоматологические причины |
|
|
Патология придаточных пазух носа |
|
|
Нарушения со стороны височно-нижнечелюстного сустава |
|
|
Невропатическая боль
|
|
|
Тригеминальные вегетативные цефалгии
|
|
|
Другие |
|
Таблица 8 Клинические различия между тригеминальной невралгией и SUNCT/SUNA (Lambru, G. Zakrzewska, J. 2021)
|
Признаки |
Тригеминальная невралгия |
SUNCT/SUNA |
|
Преимущественное распределение боли |
V2/V3>V1 |
V1>V2/V3 |
|
Интенсивность боли |
Очень выраженная |
Очень выраженная |
|
Продолжительность приступа (с) |
<1–120 |
1–600 |
|
Вегетативные симптомы |
Отсутствуют или скудные |
Выраженные |
|
Случаи с развитием только неспровоцированных приступов |
Отсутствуют или редкие |
40% |
|
Рефрактерный период |
Есть |
Нет |
|
Периодичность |
Чаще периодические |
Чаще хронические |
|
«Препараты выбора» для профилактического лечения |
Карбамазепин или окскарбазепин |
Ламотриджин |
Таблица 9 Дифференциальный диагноз между тригеминальной невралгией (ТН) с сопутствующей лицевой болью и другими тригеминальными невропатическими болями (Lambru, G. Zakrzewska, J. 2021)
|
Признаки |
ТН с сопутствующей персистирующей лицевой болью |
Идиопатическая невропатическая боль* |
Невропатическая боль с установленной причиной † |
Персистирующая идиопатическая лицевая боль |
|
Провоцирующий фактор |
Нет |
Нет |
Да: травма, воспаление, вирусная инфекция |
Нет (возможно, стресс) |
|
Локализация боли |
Экстра-/интраоральная |
Экстра-/интраоральная |
Экстра-/интраоральная |
Экстраоральная |
|
Латерализация и распределение по ветвям тройничного нерва |
Односторонняя, по дерматомному типу |
Односторонняя, по дерматомному типу |
Односторонняя, по дерматомному типу |
Часто двусторонняя, не соответствует дерматомному типу |
|
Интенсивность боли |
Интенсивная/очень интенсивная |
От лёгкой до интенсивной |
От лёгкой до интенсивной |
От лёгкой до интенсивной |
|
Сопутствующие чувствительные симптомы |
Нет |
Да |
Да |
Нет |
|
Триггерные области на коже или слизистой полости рта |
Есть |
Есть, но редко |
Есть |
Нет |
|
Эффективное лечение |
Карбамазепин |
Трициклические антидепрессанты, габапентиноиды |
Трициклические антидепрессанты, габапентиноиды |
Неизвестно |
* Включает персистирующую дентоальвеолярную боль, атипичную одонталгию, фантомную зубную боль, при которой боль локализована только внутри полости рта
† Этот термин используется преимущественно для описания посттравматической тригеминальной невропатии и постгерпетической невропатической боли
Общие принципы фармакотерапии
Назначение лекарственных препаратов остаётся основным методом лечения тригеминальной невралгии. Данные крупных исследований получены только в отношении тригеминальной невралгии. Они указывают на превосходящую эффективность антиэпилептических препаратов — карбамазепина и окскарбазепина.
Выбор препаратов для лечения боли при других краниальных невропатиях проводится в соответствии с общими принципами лечения невропатической боли — используются габапентиноиды (габапентин и прегабалин), антиэпилептические препараты других групп (ламотриджин для лечения SUNCT), трициклические антидепрессанты и антидепрессанты ИОЗСиН.
Дозировки и схемы лечения болевых синдромов при краниальных невропатиях сходны с другими невропатическими болевыми синдромами.
Список использованной литературы
- Владимирович, Б. А. (2021). Оптимизация диагностики тригеминальной невралгии с помощью МР-морфометрии тройничных нервов и оценки нейроваскулярных взаимоотношений. Диссертация на соискание ученой степени кандидата медицинских наук: 14.01.13, — Москва, 2020.138 с.https://dissercat.com/content/optimizatsiya-diagnostiki-trigeminalnoi-nevralgii-s-pomoshchyu-mr-morfometrii-troinichnykh
- Дозорова Н. С. Котов А. С. Мухина Е. В. Офтальмоплегическая краниальная невропатия: клинический случай // Русский журнал детской неврологии. 2018. №1. URL: https://cyberleninka.ru/article/n/oftalmoplegicheskaya-kranialnaya-nevropatiya-klinicheskiy-sluchay (дата обращения: 11.04.2023).
- Зайцев, А. Ю. Светлов, В. А. Дубровин, К. В. Караян, А. С. Гурьянов, В. А. & Микаелян, К. П. (2012). Внеротовая стволовая регионарная анестезия в реконструктивно-восстановительной челюстно-лицевой хирургии. Анестезиология и реаниматология, (5), 50–53.
- Клинический протокол медицинской помощи при заболеваниях височно-нижнечелюстного сустава. Утвержден на заседании Секции СтАР «Ассоциация челюстно — лицевых хирургов и хирургов-стоматологов» 21 апреля 2014 года, Москва
- Лепилин, А. В. Коннов, В. В. Багарян, Е. А. & Батусов, Н. А. (2011). Методы обследования пациентов с патологией височно-нижнечелюстных суставов и жевательных мышц (обзор). Саратовский научно-медицинский журнал, 7 (4), 914–918.
- Локальное лечение боли / Юрген Фишер; перевод с немецкого; под общей редакцией проф. О. С. Левина. — М. МЕДпресс-информ, 2018 — 8-е издание, дополненное — 192 с.
- Махинов К. А. Баринов А. Н. Жестикова М. Г. Мингазова Л. Р. Пархоменко Е. В. Лицевая боль. Журнал неврологии и психиатрии им. С. С. Корсакова. 2015; 115(7): 79‑88. Makhinov KA, Barinov AN, Zhestikova MG, Mingazova LR, Parkhomenko EV. Facial pain. Zhurnal Nevrologii i Psikhiatrii imeni S. S. Korsakova. 2015; 115(7): 79‑88. (In Russ. ).https://doi.org/10.17116/jnevro20151156179–88
- Рзаев Д. А. Денисова Н. П. Мойсак Г. И. Рогов Д. Ю. Куликова Е. В. Опыт баллонной микрокомпрессии гассерова узла в лечении тригеминальной невралгии пациентов с рассеянным склерозом. Журнал неврологии и психиатрии им. С. С. Корсакова. 2018; 118(5): 30‑35.
- Рябченко АЮ. Клиническое наблюдение рецидивирующей болевой офтальмоплегической невропатии у пациентки 49 лет. Альманах клинической медицины. 2022; 50(8): 497– 502.doi: 10.18786/2072–0505–2022–50–052.
- Шток В. Н. Головная боль. Издательство: Медицинское информационное агентство, 2007 год, ISBN 5–89481–389–1
- Шток В. Н. Некоторые замечания по поводу переработанного варианта Международной классификации головной боли (МКГБ-III, бета-версия, 2013). Журнал неврологии и психиатрии им. С. С. Корсакова. 2014; 114(2): 87‑92.
- Якупов Эдуард Закирзянович, Кузнецова Екатерина Андреевна Особенности тригемино-цервикального взаимодействия при цервикогенных головных болях // Казанский мед. ж. 2010. №5. URL: https://cyberleninka.ru/article/n/osobennosti-trigemino-tservikalnogo-vzaimodeystviya-pri-tservikogennyh-golovnyh-bolyah (дата обращения: 27.03.2023).
- Abd-Elsayed, A. (2021). Trigeminal Nerve Pain. A Guide to Clinical Management. Trigeminal Nerve Pain.https://doi.org/10.1007/978–3–030–60687–9
- Abuabat, A. & Tatwani, T. (2021). Skull Base Osteomyelitis With Facial and Trigeminal Nerve Involvement Secondary to Otitis Media. Cureus, 13(2).https://doi.org/10.7759/CUREUS. 13394
- Al-Quliti KW. Update on neuropathic pain treatment for trigeminal neuralgia. The pharmacological and surgical options. Neurosciences (Riyadh). 2015; 20(2): 107–14.https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4727618
- Belliston, S. (2019). Lacosamide Efficacy in Trigeminal Neuralgia and Other Neuropathic Pain Syndromes: A Case Series (P5.2–098). Neurology, 92(15 Supplement).
- Bendtsen, L. Zakrzewska, J. M. Abbott, J. Braschinsky, M. Di Stefano, G. Donnet, A. Eide, P. K. Leal, P. R. L. Maarbjerg, S. May, A. Nurmikko, T. Obermann, M. Jensen, T. S. & Cruccu, G. (2019). European Academy of Neurology guideline on trigeminal neuralgia. European Journal of Neurology, 26(6), 831–849.https://doi.org/10.1111/ENE. 13950
- Besi, E. Boniface, D. R. Cregg, R. & Zakrzewska, J. M. (2015). Comparison of tolerability and adverse symptoms in oxcarbazepine and carbamazepine in the treatment of trigeminal neuralgia and neuralgiform headaches using the Liverpool Adverse Events Profile (AEP). The Journal of Headache and Pain, 16(1).https://doi.org/10.1186/S10194–015–0563-Z
- Chen, Q. Yi, D. I. Perez, J. N. J. Liu, M. Chang, S. D. Barad, M. J. Lim, M. & Qian, X. (2022). The Molecular Basis and Pathophysiology of Trigeminal Neuralgia. International Journal of Molecular Sciences, 23(7).https://doi.org/10.3390/ijms23073604
- Cheshire, W. P. (2002). Defining the role for gabapentin in the treatment of trigeminal neuralgia: A retrospective study. Journal of Pain, 3(2), 137–142.https://doi.org/10.1054/jpai. 2002.122944
- Cruccu, G. Finnerup, N. B. Jensen, T. S. Scholz, J. Sindou, M. Svensson, P. Treede, R. D. Zakrzewska, J. M. & Nurmikko, T. (2016). Trigeminal neuralgia: New classification and diagnostic grading for practice and research. Neurology, 87(2), 220–228.https://doi.org/10.1212/WNL. 0000000000002840
- Deun, Laura & Witte, Muriel & Goessens, Thaïs & Halewyck, Stijn & Ketelaer, Marie-Christine & Matic, Milica & Moens, Maarten & Vaes, Peter & Van Lint, Michel & Versijpt, Jan. (2020). Facial Pain: A Comprehensive Review and Proposal for a Pragmatic Diagnostic Approach. European Neurology. 83.1–12.10.1159/000505727.
- Di Stefano, G. De Stefano, G. Leone, C. Di Lionardo, A. Di Pietro, G. Sgro, E. Mollica, C. Cruccu, G. & Truini, A. (2021). Real-world effectiveness and tolerability of carbamazepine and oxcarbazepine in 354 patients with trigeminal neuralgia. European Journal of Pain, 25(5), 1064–1071.https://doi.org/10.1002/EJP. 1727
- Di Stefano, G. Maarbjerg, S. Nurmikko, T. Truini, A. & Cruccu, G. (2018). Triggering trigeminal neuralgia. Cephalalgia : An International Journal of Headache, 38(6), 1049–1056.https://doi.org/10.1177/0333102417721677
- Di Stefano, G. Maarbjerg, S. Nurmikko, T. Truini, A. & Cruccu, G. (2018). Triggering trigeminal neuralgia. Cephalalgia : An International Journal of Headache, 38(6), 1049–1056.https://doi.org/10.1177/0333102417721677
- Dubner, R. Yang, K. Y. Kim, M. J. Ju, J. S. Park, S. K. Lee, C. G. Kim, S. T. Bae, Y. C. & Ahn, D. K. (2016). Antinociceptive Effects of Botulinum Toxin Type A on Trigeminal Neuropathic Pain. Http://Dx. Doi. Org/10.1177/0022034516659278,95(10), 1183–1190.https://doi.org/10.1177/0022034516659278
- Dworkin, R. H. O’Connor, A. B. Kent, J. Mackey, S. C. Raja, S. N. Stacey, B. R. Levy, R. M. Backonja, M. Baron, R. Harke, H. Loeser, J. D. Treede, R. D. Turk, D. C. & Wells, C. D. (2013). Interventional management of neuropathic pain: NeuPSIG recommendations. In Pain (Vol. 154, Issue 11, pp. 2249–2261). Elsevier B. V.https://doi.org/10.1016/j.pain. 2013.06.004
- Evan Calabrese, Syed M. Adil, Gary Cofer, Christian S. Perone, Julien Cohen-Adad, Shivanand P. Lad, G. Allan Johnson, Postmortem diffusion MRI of the entire human spinal cord at microscopic resolution, NeuroImage: Clinical, Volume 18,2018, Pages 963–971, ISSN 2213–1582, https://doi.org/10.1016/j.nicl. 2018.03.029.
- Fernandes EC, Carlos-Ferreira J, Luz LL, Safronov BV. Presynaptic Interactions between Trigeminal and Cervical Nociceptive Afferents Supplying Upper Cervical Lamina I Neurons. J Neurosci. 2022; 42(17): 3587–3598.doi: 10.1523/JNEUROSCI. 0025–22.2022
- Filho, A. R. G. Faccenda, P. G. Estacia, C. T. Correa, B. S. & Curi, I. (2022). Tolosa-Hunt Syndrome. Revista Brasileira de Oftalmologia, 77(5), 289–291.https://doi.org/10.5935/0034–7280.20180063
- Fromm, G. H. Terrence, C. F. & Chattha, A. S. (1984). Baclofen in the treatment of trigeminal neuralgia: double-blind study and long-term follow-up. Annals of Neurology, 15(3), 240–244.https://doi.org/10.1002/ANA. 410150306
- Gerwin, R. (2020). Chronic facial pain: Trigeminal neuralgia, persistent idiopathic facial pain, and myofascial pain syndrome—an evidence-based narrative review and etiological hypothesis. In International Journal of Environmental Research and Public Health (Vol. 17, Issue 19, pp. 1–20). MDPI AG.https://doi.org/10.3390/ijerph17197012
- Haller, S. Etienne, L. Kövari, E. Varoquaux, A. D. Urbach, H. & Becker, M. (2016). Imaging of Neurovascular Compression Syndromes: Trigeminal Neuralgia, Hemifacial Spasm, Vestibular Paroxysmia, and Glossopharyngeal Neuralgia. AJNR. American Journal of Neuroradiology, 37(8), 1384–1392.https://doi.org/10.3174/AJNR. A4683
- Hamasaki, T. Yano, S. Nakamura, K. & Yamada, K. (2018). Pregabalin as a salvage preoperative treatment for refractory trigeminal neuralgia. Journal of Clinical Neuroscience, 47,240–244.https://doi.org/10.1016/J. JOCN. 2017.10.039
- Haviv, Y. Khan, J. Zini, A. Almoznino, G. Sharav, Y. Benoliel, R. Trigeminal neuralgia (part I): Revisiting the clinical phenotype. Cephalalgia 2016,36,730–746.
- Hayreh SS. Ischemic optic neuropathy. Prog Retin Eye Res. 2009 Jan; 28(1): 34–62.doi: 10.1016/j.preteyeres. 2008.11.002. Epub 2008 Nov 27. PMID: 19063989.
- Hu, J. W. & Woda, A. (2013). Trigeminal Brainstem Nuclear Complex, Physiology. In Encyclopedia of Pain (pp. 4060–4065). Springer Berlin Heidelberg.https://doi.org/10.1007/978–3–642–28753–4_4604
- Iaconetta G, Stella L, Esposito M, Cappabianca P. Tolosa-Hunt syndrome extending in the cerebello-pontine angle. Cephalalgia. 2005 Sep; 25(9): 746–50.
- Kulkarni, A. (2022). Complex Neurovascular Syndromes: Is the Compressing Vessel Alone the Culprit? Journal of Neurosciences in Rural Practice, 13(2), 283–289.https://doi.org/10.1055/s-0042–1744125
- Lambru, G. Zakrzewska, J. & Matharu, M. (2021). Trigeminal neuralgia: a practical guide. Practical Neurology, 21(5), 392–402.https://doi.org/10.1136/PRACTNEUROL-2020–002782
- Launay, P. S. Reboussin, E. Liang, H. Kessal, K. Godefroy, D. Rostene, W. Sahel, J. A. Baudouin, C. Melik Parsadaniantz, S. & Reaux Le Goazigo, A. (2016). Ocular inflammation induces trigeminal pain, peripheral and central neuroinflammatory mechanisms. Neurobiology of Disease, 88,16–28.https://doi.org/10.1016/j.nbd. 2015.12.017
- Lee, J. W. & Dworetzky, B. (2010). Rational Polytherapy with Antiepileptic Drugs. Pharmaceuticals, 3(8), 2362.https://doi.org/10.3390/PH3082362
- Maarbjerg, S. Gozalov, A. Olesen, J. & Bendtsen, L. (2014). Trigeminal neuralgia-a prospective systematic study of clinical characteristics in 158 patients. Headache, 54(10), 1574–1582.https://doi.org/10.1111/HEAD. 12441
- Maarbjerg, S. Gozalov, A. Olesen, J. & Bendtsen, L. (2014). Trigeminal neuralgia-a prospective systematic study of clinical characteristics in 158 patients. Headache, 54(10), 1574–1582.https://doi.org/10.1111/head. 12441
- Maarbjerg, S. Wolfram, F. Gozalov, A. Olesen, J. & Bendtsen, L. (2015). Association between neurovascular contact and clinical characteristics in classical trigeminal neuralgia: A prospective clinical study using 3.0 Tesla MRI. Cephalalgia, 35(12), 1077–1084.https://doi.org/10.1177/0333102414566819
- Maarbjerg, S. Gozalov, A. Olesen, J. Bendtsen, L. Concomitant persistent pain in classical trigeminal neuralgia—Evidence for different subtypes. Headache 2014,54,1173–1183
- Maggioni F, Briani C, Margoni M, Zanchin G. Ophthalmoplegic migraine: could electroencephalogram still be a useful tool to better understand the pathogenetic mechanism? Cephalalgia. 2012 Dec; 32(16): 1227–9.doi: 10.1177/0333102412462641. Epub 2012 Oct 10. PMID: 23053303.
- Mannheimer B, Andersson ML, Järnbert-Pettersson H, Lindh JD. The effect of carbamazepine on warfarin anticoagulation: a register-based nationwide cohort study involving the Swedish population. J Thromb Haemost. 2016 Apr; 14(4): 765–71.doi: 10.1111/jth. 13268. Epub 2016 Mar 8. PMID: 26792124.
- Masrour, S. (2022). Lacosamide for refractory trigeminal neuralgia and other facial pain—Case report. Headache: The Journal of Head and Face Pain.https://doi.org/10.1111/HEAD. 14367
- Montano N, Conforti G, Di Bonaventura R, Meglio M, Fernandez E, Papacci F. Advances in diagnosis and treatment of trigeminal neuralgia. Ther Clin Risk Manag. 2015; 11:289–299. Published 2015 Feb 24.doi: 10.2147/TCRM. S37592
- Moore, D. Chong, M. S. Shetty, A. & Zakrzewska, J. M. (2019). A systematic review of rescue analgesic strategies in acute exacerbations of primary trigeminal neuralgia. BJA: British Journal of Anaesthesia, 123(2), e385.https://doi.org/10.1016/J. BJA. 2019.05.026
- Moshirfar, M. Benstead, E. E. Sorrentino, P. M. & Tripathy, K. (2023). Ocular Neuropathic Pain. StatPearls.https://www.ncbi.nlm.nih.gov/books/NBK542282/
- Mullan S, Lichtor T. Percutaneous microcompression of the trigeminal ganglion for trigeminal neuralgia. J Neurosurg. 1983 Dec; 59(6): 1007–12.doi: 10.3171/jns. 1983.59.6. 1007. PMID: 6631493.
- Obermann, M. (2012). Pain Lateralization in Trigeminal Neuralgia. Anesthesiology and Pain Medicine, 2(1), 46.https://doi.org/10.5812/AAPM. 3448
- Obermann, M. Yoon, M. S. Sensen, K. Maschke, M. Diener, H. C. & Katsarava, Z. (2008). Efficacy of pregabalin in the treatment of trigeminal neuralgia. Cephalalgia : An International Journal of Headache, 28(2), 174–181.https://doi.org/10.1111/J. 1468–2982.2007.01483. X
- Ogino, M. H. & Tadi, P. (2022). Neuroanatomy, Trigeminal Reflexes. StatPearls.https://www.ncbi.nlm.nih.gov/books/NBK551641/
- On the Natural History of Trigeminal Neuralgia. /. K. Burchiel, K. Slavin // Neurosurgery. – 2000. – Vol. 46 — Issue. 1 — p. 152–155.https://pubmed.ncbi.nlm.nih.gov/10626945/
- Park J, Park HJ. Botulinum toxin for the treatment of neuropathic pain. Toxins. 2017; 9:260.https://doi.org/10.3390/toxins9090260.
- Pulcini A. Guerin J. P. Head and Neck. In: Handbook of regional anesthesia. ESRA; 2007.16—48.
- Robblee J. A pain in the ear: Two case reports of nervus intermedius neuralgia and narrative review. Headache. 2021 Mar; 61(3): 414–421.doi: 10.1111/head. 14066. Epub 2021 Feb 15. PMID: 33586784.
- Rockliff, B. W. & Davis, E. H. (1966). Controlled Sequential Trials of Carbamazepine in Trigeminal Neuralgia. Archives of Neurology, 15(2), 129–136.https://doi.org/10.1001/ARCHNEUR. 1966.00470140019003
- Roger K. Cady, Kathleen Farmer, Paul Mathew and B. Lee Peterlin, G. W. J. (2009). Clinician’s Guide to Chronic Headache and Facial Pain — 1st Edition (G. W. Jay (ed. )).https://www.routledge.com/Clinicians-Guide-to-Chronic-Headache-and-Facial-Pain/Jay/p/book/9781138116733
- Romano, N. Federici, M. & Castaldi, A. (2019). Imaging of cranial nerves: a pictorial overview. Insights into Imaging, 10(1), 1–21.https://doi.org/10.1186/S13244–019–0719–5/FIGURES/33
- Rubis, A. & Juodzbalys, G. (2020). The Use of Botulinum Toxin A in the Management of Trigeminal Neuralgia: a Systematic Literature Review. Journal of oral & maxillofacial research, 11(2), e2.https://doi.org/10.5037/jomr. 2020.11202
- Rustagi A, Roychoudhury A, Bhutia O, Trikha A, Srivastava MV. Lamotrigine versus pregabalin in the management of refractory trigeminal neuralgia: a randomised open label crossover trial. J Maxillofac Oral Surg. 2014; 13:409–18.
- Schnell, S. Marrodan, M. Acosta, J. N. Bonamico, L. & Goicochea, M. T. (2020). Trigeminal Neuralgia Crisis – Intravenous Phenytoin as Acute Rescue Treatment. Headache: The Journal of Head and Face Pain, 60(10), 2247–2253.https://doi.org/10.1111/HEAD. 13963
- Sechi E, Cacciaguerra L, Chen JJ, et al. Myelin Oligodendrocyte Glycoprotein Antibody-Associated Disease (MOGAD): A Review of Clinical and MRI Features, Diagnosis, and Management. Front Neurol. 2022; 13:885218. Published 2022 Jun 17.doi: 10.3389/fneur. 2022.885218
- Sessle, B. J. (2000). Acute and chronic craniofacial pain: Brainstem mechanisms of nociceptive transmission and neuroplasticity, and their clinical correlates. In Critical Reviews in Oral Biology and Medicine (Vol. 11, Issue 1, pp. 57–91). Intern.and American Associations for Dental Research.https://doi.org/10.1177/10454411000110010401
- Shaikh S, Yaacob HB, Abd Rahman RB. Lamotrigine for trigeminal neuralgia: efficacy and safety in comparison with carbamazepine. J Chin Med Assoc. 2011; 74:243–9.
- Sisodiya, S. M. Sander, J. W. A. S. & Patsalos, P. N. (2002). Carbamazepine toxicity during combination therapy with levetiracetam: A pharmacodynamic interaction. Epilepsy Research, 48(3), 217–219.https://doi.org/10.1016/S0920–1211(01)00309–6
- Slater, L. Slater, A. Braca, J. Le, B. & Zimmerman, R. (2021). An uncommon case of neurosarcoidosis presenting as trigeminal neuralgia. Journal of Community Hospital Internal Medicine Perspectives, 11(2), 224–227.https://doi.org/10.1080/20009666.2020.1869381
- Swartz NG, Beck RW, Savino PJ, Sergott RC, Bosley TM, Lam BL, Drucker M, Katz B. Pain in anterior ischemic optic neuropathy. J Neuroophthalmol. 1995 Mar; 15(1): 9–10.doi: 10.3109/01658109509044588. PMID: 7780575.
- The International Classification of Headache Disorders, 3rd edition. Cephalalgia, 2018, Vol. 38(1) 1–211, ! International Headache Society 2018, sagepub.co.uk/journalsPermissions.nav, DOI: 10.1177/0333102417738202.journals.sagepub.com/home/cep
- Vogl C. Mochida S. Wolff C. Whalley B. Stephens G. The synaptic vesicle glycoprotein SA ligand levetiracetam inhibits presynaptic Ca2+ channels through an intracellular pathway. Mol Pharmacol. 2012; 82(2): 199–208.
- Wang, Q. P. & Bai, M. (2011). Topiramate versus carbamazepine for the treatment of classical trigeminal neuralgia: a meta-analysis. CNS Drugs, 25(10), 847–857.https://doi.org/10.2165/1159
- Wang, Q. P. & Bai, M. (2011). Topiramate versus carbamazepine for the treatment of classical trigeminal neuralgia: a meta-analysis. CNS Drugs, 25(10), 847–857.https://doi.org/10.2165/11595590–000000000–00000
- Wiffen PJ, Derry S, Moore RA. Lamotrigine for acute and chronic pain. Cochrane Database Syst Rev. 2011; 16: CD006044.
- Wiffen, P. J. Collins, S. McQuay, H. J. Carroll, D. Jadad, A. & Moore, R. A. (2005). Anticonvulsant drugs for acute and chronic pain. In Cochrane Database of Systematic Reviews (Issue 3). John Wiley & Sons, Ltd.https://doi.org/10.1002/14651858.cd001133.pub2
- Wilker SC, Rucker JC, Newman NJ, Biousse V, Tomsak RL. Pain in ischaemic ocular motor cranial nerve palsies. Br J Ophthalmol. 2009; 93(12): 1657–1659.doi: 10.1136/bjo. 2008.155150
- Wolf, E. Kothari, N. R. Roberts, J. K. & Sparks, M. A. (2018). Baclofen Toxicity in Kidney Disease. American Journal of Kidney Diseases : The Official Journal of the National Kidney Foundation, 71(2), 275–280.https://doi.org/10.1053/J. AJKD. 2017.07.005
- Yamamoto, J. Toublanc, N. Kumagai, Y. & Stockis, A. (2014). Levetiracetam Pharmacokinetics in Japanese Subjects with Renal Impairment. Clinical Drug Investigation, 34(11), 819–828.https://doi.org/10.1007/s40261–014–0237–7
- Yang X, Li X, Lai M, Wang J, Tan S, Chan HH. Pain Symptoms in Optic Neuritis. Front Pain Res (Lausanne). 2022; 3:865032. Published 2022 Apr 14.doi: 10.3389/fpain. 2022.865032
- Zakrzewska J. M. Chaudhry Z. Nurmikko TJ, Patton DW, Mullens EL. Lamotrigine (lamictal) in refractory trigeminal neuralgia: results from a double-blind placebo-controlled crossover trial. Pain. 1997; 73:223–30.
- Zakrzewska JM, Linskey ME. Trigeminal neuralgia. BMJ Clin Evid. 2014; 6:2014.
- Zakrzewska, J. M. & Linskey, M. E. (2015). Trigeminal neuralgia. BMJ (Clinical Research Ed. ), 350.https://doi.org/10.1136/BMJ. H1238
- Zakrzewska, J. M. Wu, J. Mon-Williams, M. Phillips, N. & Pavitt, S. H. (2017). Evaluating the impact of trigeminal neuralgia. Pain, 158(6), 1166–1174.https://doi.org/10.1097/J. PAIN. 0000000000000853
- Zhang J, Yang M, Zhou M, He L, Chen N, Zakrzewska JM. Non-antiepileptic drugs for trigeminal neuralgia. Cochrane Database of Systematic Reviews2013, Issue 12. Art. No. CD004029. DOI: 10.1002/14651858. CD004029.pub4.https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858. CD004029.pub4/epdf/full
- Ziegeler, C. Brauns, G. & May, A. (2021). Characteristics and natural disease history of persistent idiopathic facial pain, trigeminal neuralgia, and neuropathic facial pain. Headache, 61(9), 1441–1451.https://doi.org/10.1111/HEAD. 14212
- Zurak N, Mahovic D. Idiopathic Trigeminal Neuralgia (ITN): Facts and Fiction. Psychiatr Danub. 2019 Dec; 31(Suppl 5): 724–731. PMID: 32160164.
[1] Оральная, межполюсная (промежуточная) и каудальная части
[2] Термин «невралгия» используется для описания одного из клинических проявлений невропатии — кратковременных интенсивных приступов боли в области иннервации нерва, которые могут сочетаться с другими нарушениями функции данного нерва.
[3] Случаи невралгии тройничного, языкоглоточного и промежуточной ветви лицевого нерва (n.intermedius), вызванной нейроваскулярным конфликтом, обозначаются как «классическая невралгия».
Строго говоря, это один из видов вторичной невралгии, но выделение его оправдано ввиду более широких возможностей по лечению и различий патофизиологических изменений нерва.
[4] Abd-Elsayed, A. (2021). Trigeminal Nerve Pain. A Guide to Clinical Management. Trigeminal Nerve Pain. https://doi.org/10.1007/978–3–030–60687–9
[5] Чаще, 5 мг/кг массы тела/ч, в течение 60–90 минут
[6] Болевые рецепторы, чувствительные к капсаицину (алкиламид гомованилиновой кислоты). Активация рецепторов капсаицином отличается от их возбуждения под действием стандартных болевых стимулов. После действия капсаицина наблюдается длительный период рефрактерности, когда рецепторы не реагируют на болевые стимулы.
[7] Атипичная тригеминальная невралгия
[8] Американская некоммерческая организация, обеспечивающая поддержку людей, страдающих редкими заболеваниями напрямую, при помощи образовательных программ и финансирования фундаментальных исследований, координации работы организаций, оказывающих социальную и медицинскую помощь
Материал подготовил: врач-невролог Яблонский М. А.