Определение
Мигрень — пароксизмальное расстройство, основным симптомом которого является интенсивная головная боль, обычно в сочетании с тошнотой и/или свето — и звукобоязнью.
Приступы мигрени — одна из наиболее распространённых причин обращения за амбулаторной помощью, значимая причина нетрудоспособности.
Этиология и патогенез
Современные представления предполагают первичную роль нейрональной дисфункции в развитии интракраниальных и экстракраниальных изменений, приводящих к развитию мигрени. В развитии приступа выделяется четыре фазы: продром, аура, головная боль и постдром.
Некогда популярная сосудистая теория мигрени, которая предполагает связь развития мигренозной головной боли с расширением кровеносных сосудов, а симптомы ауры — с их сужением, в настоящее время потеряла актуальность. Вазодилятация, если и возникает во время приступов мигрени, рассматривается как эпифеномен (вторичное патологическое явление), вызванный нестабильностью центральных механизмов контроля работы нейроваскулярного звена.
Распространяющаяся корковая депрессия — причинная связь между аурой мигрени и головной болью поддерживается данным о связи обоих состояний с феноменом, известным как «распространяющаяся корковая депрессия» Leão. Распространяющаяся корковая депрессия — самораспространяющаяся волна деполяризации мембран нейронов и глиальных клеток коры головного мозга. Распространяющаяся корковая депрессия предположительно является причиной:
- развития симптомов ауры мигрени;
- активации афферентных волокон тройничного нерва;
- изменения проницаемости гематоэнцефалического барьера посредством активации и повышающей регуляции матриксных металлопротеиназ.
Активация афферентных нейронов тройничного нерва под действием распространяющейся корковой депрессии, в свою очередь, вызывает воспалительные изменения в обладающих болевой чувствительностью оболочках мозга, что, с участием центральных и периферических рефлекторных механизмов, вызывает мигренозную головную боль. Это вероятный молекулярный каскадный механизм, который при участии сенсетизированных афферентных нейронов тройничного нерва, активированных вследствие распространяющейся корковой депрессии, приводит к открытию больших трансмембранных каналов нейронов паннексин-1 с последующей активацией каспазы-1, что приводит к высвобождению провоспалительных медиаторов, активации ядерного фактора каппа-би (NF-kB) в астроцитах, передаче воспалительного сигнала к волокнам тройничного нерва, окружающим сосуды мягкой мозговой оболочки (пиальные). Таким образом, этот механизм связывает распространяющуюся корковую депрессию, феномен, предположительно, лежащий в основе ауры мигрени, с длительной активацией тригеминальных структур ноцицептивной системы, лежащей в основе развития мигренозной головной боли.
Высказано предположение, что мигрень без ауры может быть вызвана распространяющейся корковой депрессией в участках головного мозга (например, мозжечке), деполяризация нейронов которых не приводит к развитию симптомов, ощущаемых пациентом.
Тригеминоваскулярная система — патофизиология мигрени включает активацию тригеминоваскулярной системы, которая состоит из тонких волокон псевдоуниполярных сенсорных нейронов, расположенных в узле тройничного нерва и спинномозговых ганглиях верхних шейных сегментов спинного мозга. Эти сенсорные нейроны отдают проекции к крупным церебральным сосудам, сосудам мягкой и твёрдой мозговой оболочек, венозным синусам. Иннервация сосудов передней части церебрального кровотока осуществляется преимущественно через глазную (I) ветвь тройничного нерва, а задней — с большим вкладом верхних шейных корешков.
Конвергенция проекций от корешков верхних шейных сегментов спинного мозга и тройничного нерва происходит в каудальной части ядра спинального тракта (чувствительное ядро тройничного нерва). Эта конвергенция может объяснить распространение мигренозной боли, часто в передней или задней области головы и верхней части шеи. Поступив в каудальную часть ядра спинального тракта, центральные сигналы могут подвергаться модулирующим воздействиям от ростральных ядер тройничного нерва, околоводопроводного серого вещества и большого ядра шва, а также, нисходящих тормозных корковых эфферентов.
Из каудальной части ядра спинномозгового пути, волокна, сохраняющие топическое распределение болевых стимулов, следуют к таламусу и областям коры, отвечающим за чувствительность. Другие вторые нейроны из ядра спинального пути тройничного нерва отдают проекции к многочисленным подкорковым структурам, включая более ростральные сегменты комплекса ядер тройничного нерва, ретикулярной формации ствола головного мозга, мозжечка, среднего мозга и парабрахиальных ядер Варолиева моста, вентробазальным ядрам таламуса, задним и медиальным отделам таламуса. Из ростральных ядер ствола головного мозга, информация о боли передаётся в другие области головного мозга (например, лимбические), вовлечённые в эмоциональный или вегетативный ответ на боль.
Стимуляция ганглия тройничного нерва приводит к высвобождению вазоактивных пептидов, включая субстанцию P, кальцитонин-ген-связанный пептид и нейрокинин А. Высвобождение этих нейропептидов сопровождается развитием нейрогенного воспаления. Двумя основными составляющими этого асептического воспалительного ответа являются расширение сосудов (кальцитонин-ген-связанный пептид является мощным вазодилятатором) и экстравазация плазменных белков.
Нейрогенное воспаление рассматривается как важный механизм увеличения интенсивности и продолжительности мигренозной головной боли. У пациентов с хронической мигренью выявляются повышенные уровни вазоактивных пептидов, что указывает на активацию тригеминоваскулярной системы у этих пациентов. Нейрогенное воспаление может быть причиной сенсетизации.
Сенситизация — термин сенситизация обозначает процесс повышения способности нейронов отвечать болевые стимулы и стимулы другой модальности: порог ответа снижается, величина ответа повышается, увеличивается размер рецепторных полей, развивается спонтанная активность нейронов. Периферическая сенситизация первых афферентных нейронов и центральная сенситизация вторых нейронов в ядре спинального пути тройничного нерва нейронов более высоких центров, вероятно, играет роль в развитии отдельных приступов мигрени, возможно, и в трансформации эпизодической мигрени в хроническую.
Сенситизация, вероятно отвечает за многие клинические симптомы мигрени, включая пульсирующий характер боли, ухудшение боли при кашле, наклоне или резких движениях головы (часто наблюдается в постдроме), гипералгезия (повышение чувствительности к болевым стимулам) или аллодиния (раздражители, в норме не вызывающие боли, рассматриваются как болевые).
При помощи функциональной нейровизуализации у пациентов, страдающих мигренью были выявлены нарушения восходящих и нисходящих проводящих путей, как во время приступов, так и между приступами. Были выявлены нарушения притока крови к дорсальным отделам Варолиева моста, передним отделам коры поясной извилины и слуховой ассоциативной коры. У пациентов с хронической мигренью были выявлены нарушения кровотока в дорсальных отделах Варолиева моста, передних отдела коры поясной извилины и области клина.
Также выявлялись структурные изменения мозга. Исследования указывают, что у пациентов с мигренью более быстро развивается истончение коры в зрительных областях, отвечающих за обработку информации о движении, повышение плотности околоводопроводного и дорсолатеральных отделов ствола мозга, снижен объём серого вещества в передних отделах поясной извилины и островка. У пациентов с хронической и эпизодической мигренью выделено повышение количества железа в околоводопроводном сером веществе.
Роль серотонина — несмотря на то, что значение активации серотониновых рецепторов в лечении приступа мигрени хорошо установлена, роль нейромедиатора в развитии мигрени недостаточно понятна. Некоторые авторы сообщают, что серотонин (высвобождающийся из серотонинергических ядер ствола головного мозга) играет роль в патогенезе мигрени, возможно, посредством прямого действия на внутричерепные сосуды, влияния медиатора на центральные механизмы контроля боли или корковые проекции серотонинергических ядер ствола головного мозга. Наличие этих механизмов действия серотонина подтверждается эффективностью трициклических препаратов, блокирующих обратный захват серотонина, в качестве средств для профилактики мигрени. В противоположность этому, более селективные ингибиторы захвата серотонина не обладают высокой эффективностью для профилактики мигрени. Получены данные о связи низкой концентрации серотонина с развитием дефицита медиатора в нисходящих системах, подавляющих болевые сигналы, что, взаимодействуя с распространяющейся корковой депрессией, усиливает активацию тригеминоваскулярных ноцицептивных путей.
Роль кальцитонин-ген-связанного пептида (КГСП) — кальцитонин-ген-связанный пептид может также играть роль в развитии мигрени. КГСП — нейропептид, состоящий из 37 аминокислотных остатков, который экспрессируется в нейронах ганглия тройничного нерва и является мощным вазодилататором, действующим на сосуды головного мозга и твёрдой мозговой оболочки.
КГСП может выступать в качестве медиатора, передающего болевые импульсы в тригеминоваскулярной системе (церебральные сосуды), обладающего сосудорасширяющим действием, как участник процесса нейрогенного воспаления. Однако, доказательства противоречивы. Стимуляция ганглия тройничного нерва вызывает высвобождение КГСП, а инфузия КГСП может провоцировать приступы мигрени у пациентов, страдающих заболеванием. У здоровых лиц без мигрени, в плацебо-контролируемом перекрёстном исследовании было установлено, что инфузия экзогенного КГСП вызывает расширение средней менингеальной (экстракраниальной), но не средней мозговой (интракраниальной) артерии, в то время как инфузия суматриптана вызывает вазоконстрикцию средней менингеальной артерии. Слабое расширение интракраниальной артерии в ответ на внутривенное введение КГСП в этом исследовании может объясняться неспособностью экзогенного КГСП проникать через гематоэнцефалический барьер. Однако, в одном исследовании было выявлено повышение уровня КГСП в крови наружной ярёмной вены во время приступа мигрени, в последующем исследовании, этот результат не был воспроизведён. Кроме того, КГСП не вызывал ни активации, ни сенсетизации болевых рецепторов мозговых оболочек в животных моделях.
Назначение агониста 1b/1d серотониновых рецепторов — суматриптана приводило к нормализации повышенного уровня КГСП, что указывает на способность триптанов контролировать мигрень, как минимум, блокируя высвобождение КГСП.
Фармакологическая модуляция КГСП является многообещающим методом лечения приступов мигрени.
Обратный (справа налево) сброс крови в сердце — Мигрень с аурой связана с обратным сбросом крови в сердце, обычно через открытое овальное окно или, значительно реже, через дефект межпредсердной перегородки (ДМПП) и артериовенозные мальформации при врождённых геморрагических телеангиоэктазиях (синдром Вебера-Рендю-Ослера).
Указания на связь мигрени с ООО противоречивы.
В популяционном исследовании с участием 1101 лиц, у которых не было развития инсульта (средний возраст 69 лет) из когорты NOMAS (Northern Manhattan Cohort Study), и у которых оценивалось наличие ООО с использованием трансторакальной эхокардиографии с использованием физиологического раствора в качестве контраста и проведением провоцирующих манёвров, не было выявлено значимой разницы в распространённости ООО у пациентов с мигренью и лиц, у которых не было мигрени (14,6 по сравнению с 15,0%). Не установлено сочетания ООО с повышением распространённости мигрени (отношение шансов [ОШ] 1,01,95% ДИ 0,63–1,61) или повышением распространённости мигрени с аурой (ОШ 1,01,95% ДИ 0,71–1,69) по сравнению с пациентами без мигрени.
В систематическом обзоре исследований случай-контроль, опубликованном в 2008 году, было установлено, что мигрень с аурой (но, не без ауры) более распространена у пациентов с ООО, чем в общей популяции, однако, ООО чаще выявляется у пациентов с мигренью с аурой, чем в общей популяции.
К настоящему времени нет возможности сделать однозначные выводы, но в популяционном исследовании NOMAS получены наблюдения высокого качества о том, что ООО не связано с повышением риска мигрени. В противоположность этом, в системном обзоре связь ООО и мигрени подтверждается данными умеренной или низкой степени доказательства.
Механизм возможной связи между сбросом крови справа налево в сердце и мигренью не установлен. Одна из теорий предполагает роль генетических факторов, предрасполагающих одновременно к повышенному риску развития аномалией строения межпредсердной перегородки и мигрени. Эти теории сосредоточены на образовании шунтов. Например, одна из гипотез предполагает наличие в венозном кровотоке вазоактивных агентов, которые могут вызывать мигрень; в норме они инактивируются в лёгких, но могут поступать в мозговой кровоток при наличии шунтирования справа налево. Другая гипотеза говорит о том, что наличие шунта обеспечивает возможность парадоксальной эмболии с последующим развитием ишемии головного мозга, что провоцирует приступы мигрени.
Генетические причины мигрени
Мигрень — синдромальное неврологическое заболевание, в большинстве случаев, имеющее наследственный характер. Как и в случае всех распространённых заболеваний, генетическая природа мигрени, вероятно, комплексная и у отдельных пациентов может наблюдаться суммирование вклада более чем одного генетически обусловленного механизма. У лиц, склонных к развитию мигрени, есть генетические изменения, снижающие порог чувствительности к развитию приступов мигрени, последние возникают при нарушении баланса между провоцирующими и сдерживающими факторами на различных уровнях нервной системы. С развитием мигрени у отдельных лиц или групп людей связывались малозначимые аномалии, включая изменения работы ферментных систем, рецепторов и мембранных каналов.
О важности наследственных факторов в развитии мигрени известно достаточно давно. В одном раннем исследовании, оценивающем общую популяцию, было установлено, что риск развития мигрени у родственников страдающих заболеванием, в три раза выше, чем у родственников контрольной группы (без мигрени). Однако, при сегрегационном анализе не было установлено единого менделевского паттерна наследования распространённых форм мигрени. В двух близнецовых исследованиях, выполненных с использованием данных близнецовых регистров, была подтверждена более высокая конкордантность развития мигрени у монозиготных близнецов по сравнению с дизиготными. В одном исследовании, при использовании полигенной мультифакториальной модели, было установлено, что наследственность отвечает за 40–50% индивидуальной предрасположенности к мигрени.
Генетические основы наиболее распространённых форм мигрени (мигрень с аурой и мигрень без ауры) не были установлены, несмотря на большое количество накопленных данных. С развитием мигрени связывают несколько генов-кандидатов, к которым относятся KCNK18 — ген, кодирующий двухпоровый калиевый канал, и CSNK1D — ген, кодирующий изоформу дельта казеин-киназы I. Однако, эти находки в генетических исследованиях мигрени не описываются в последующих работах. Например, при плановой повторной оценке 27 генов перспективных кандидатов на причину мигрени в большом наборе данных общегеномного исследования ассоциаций (GWAS), у 5175 пациентов с мигренью и 13972 лиц контрольной группы не выявило генов-кандидатов, вклад которых достигал порога статистической значимости. Таким образом, остаются неустановленными локусы и гены, в действительности принимающие участие в патогенезе мигрени.
Распространённые формы мигрени, вероятно, — комплексные генетические расстройства, что предполагает взаимодействие множественных генов различной локализации со средовыми факторами, приводящее к повышению риска заболевания и симптомов у подверженных заболеванию лиц. Возможным объяснение недостаточной воспроизводимости результатов генетических исследований мигрени, является то, что полиморфизм небольшого количества генов, которые часто исследуются в относительно небольшой популяции, в которой мигренью страдает только часть людей, и причиной является только исследуемый ген, в то время как у других пациентов, развитие мигрени имеет другую природу. Ожидается снижение силы доказательств многих из этих исследований для выявления значимых различий между пациентами, страдающими мигренью и лицами контрольной группы. В конечном итоге, выделение генов, отвечающих за развитие мигрени у отдельного пациента является очень важным, поскольку может быть использовано для выбора профилактического лечения, которое будет эффективным.
Семейная гемиплегическая мигрень — гемиплегическая мигрень может возникать как семейное наследственное, так и спорадическое заболевание (у отдельных пациентов). Первые три типа семейной гемиплегической мигрени (СГМ) являются каналопатиями СГМ1 вызывается мутациями гена CACNA1A, СГМ2 — мутациями гена ATP1A2, а СГМ3 — мутациями гена SCN1A. Мутации гена PRRT2 также служат причиной отдельных случаев гемиплегической мигрени. Изученные типы семейной гемиплегической мигрени составляют лишь небольшое количество случаев.
Эпидемиология
Распространённость мигрени в популяции находится в пределах 2,6–21,7%. Интересным фактом, указывающим на связь вероятности обращения пациента с осведомлённостью о болезни, является большая распространённость мигрени среди неврологов 27,6 — 48,6%.
Мигрень с аурой составляет до 75% от общего количества случаев мигрени.
Данные нескольких ретроспективных национальных когортных исследований, выполненных в Тайване одной и той же группой авторов, указывают, что мигрень является фактором риска развития невропатии лицевого нерва (паралича Белла), нейросенсорной тугоухости и парезов глазодвигательных нервов.
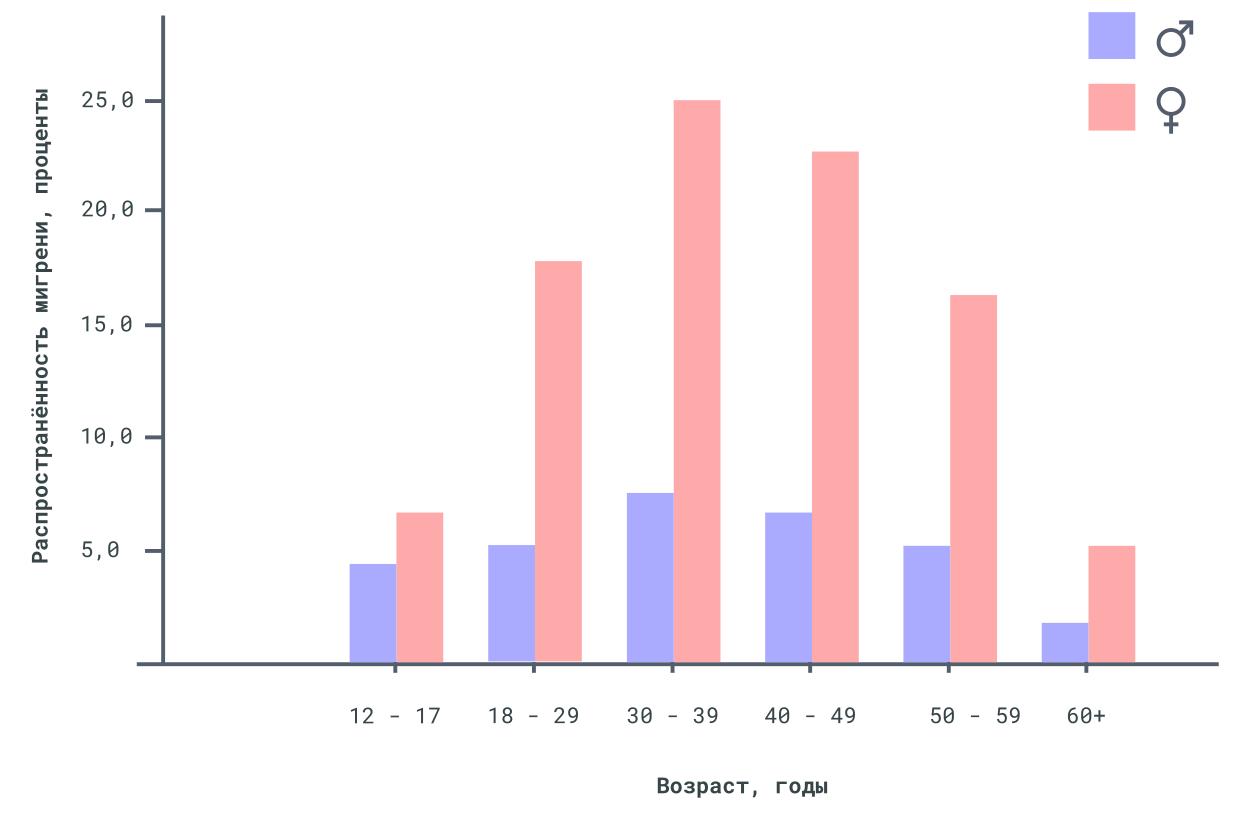
Рисунок 1. Распространённость мигрени
Lipton, RB, Bigal, ME, Diamond, M, et al. Migraine prevalence, disease burden, and the need for preventative therapy. Neurology 2007; 68:343.
Мигрень и инсульт
У мигрени и ишемического инсульта есть сходные (1) патогенез, (2) факторы риска и (3) клинические и визуализационные признаки (Zhang Y, Parikh A, 2017).
Симптоматическая мигрень является следствием структурных повреждений головного мозга, васкулопатий и сосудистых мальформаций, вызывающими повторное развитие симптомов мигрени с аурой. Артериовенозные мальформации (АВМ) могут быть связаны с развитием мигренозных приступов (Monteiro JM, Rosas MJ, 1993). В одном литературном обзоре была выявлена корреляция стороны расположения АВМ и односторонней головной боли, а также — односторонней ауры (Haas DC, 1991). Приступы мигрени могут сочетаться с церебральной аутосомно-доминантной артериопатией с субкортикальными инфарктами и лейкоэнцефалопатией (CADASIL) и митохондриальной энцефалопатией с лактат-ацидозом и инсультоподобными симптомами (MELAS).
Клиническая картина острого инсульта (ишемического инсульта, церебрального венозного тромбоза и субарахноидального кровоизлияния) может быть неотличима от мигрени, ввиду чего, инсульт относят к состояниям-»маскам» мигрени. Мигрень с аурой отвечает за 18% ошибочно выполненных тромболизисов по причине подозрения на ишемический инсульт (Terrin A, Toldo G, 2018).
Диссекция прецеребральной части внутренней сонной артерии может проявляться клиникой мигрени, пульсирующей зрительной скотомой. В исследовании с участием 161 пациента, было установлено, что около 70% случаев диссекции прецеребральных отделов сонных и позвоночных артерий сопровождаются головной болью; головная боль как первый симптом отмечается в 33–47% случаев. В выполненном ранее исследовании, было установлено, что у 19 из 21 пациента с установленной по данным ангиографии диссекцией сонной артерии, отмечалась односторонняя головная боль и одной или нескольких областях: лобной, орбитальной. Головная боль обычно острая и интенсивная, боль в шее была отмечена у 12 пациентов. Около 3-х четвертей из 21 пациента переносили ишемические осложнения диссекции, в половине случаев, симптомам ишемического повреждения мозга предшествовала головная боль.
Частота мигренозных инсультов (инфаркты, возникающие в области головного мозга, топически соответствующей локализации ауры у пациентов, страдающих мигренью с аурой) невелика. Данные о повышении частоты инсультов вдвое у лиц страдающих мигренью с аурой не имеют большого абсолютного значения, ввиду того, что относительный риск у пациентов, страдающих мигренью невелик ввиду их молодого возраста (Tzourio C, Tehindrazanarivelo A, 1995).
Риск инсульта при мигрени значительно выше у женщин (совокупный относительный риск (ОР) 2,08,95% ДИ 1,13–3,84), чем у мужчин (совокупный ОР 1,37,95% ДИ 0,89–2,11), у курильщиков, страдающих мигренью с аурой (совокупный ОР 9,95% ДИ 4,2–19,3), женщин, страдающих мигренью с аурой и принимающих оральные контрацептивы (совокупный ОР 7,95% ДИ 1,5–32,7).
На основании данных о сочетании инсульта и мигрени, пациентам с выявленными сосудистыми заболеваниями не рекомендуются к использованию триптаны и агонисты серотонина.
Женщины, страдающие мигренью без ауры, в отсутствии других факторов риска инсульта, могут принимать контрацептивы, содержащие низкие дозы эстрогенов (менее 50 мкг). Женщинам, страдающим мигренью с аурой необходимо рекомендовать отказ от курения, контроль артериального давления и альтернативные оральным методы контрацепции.
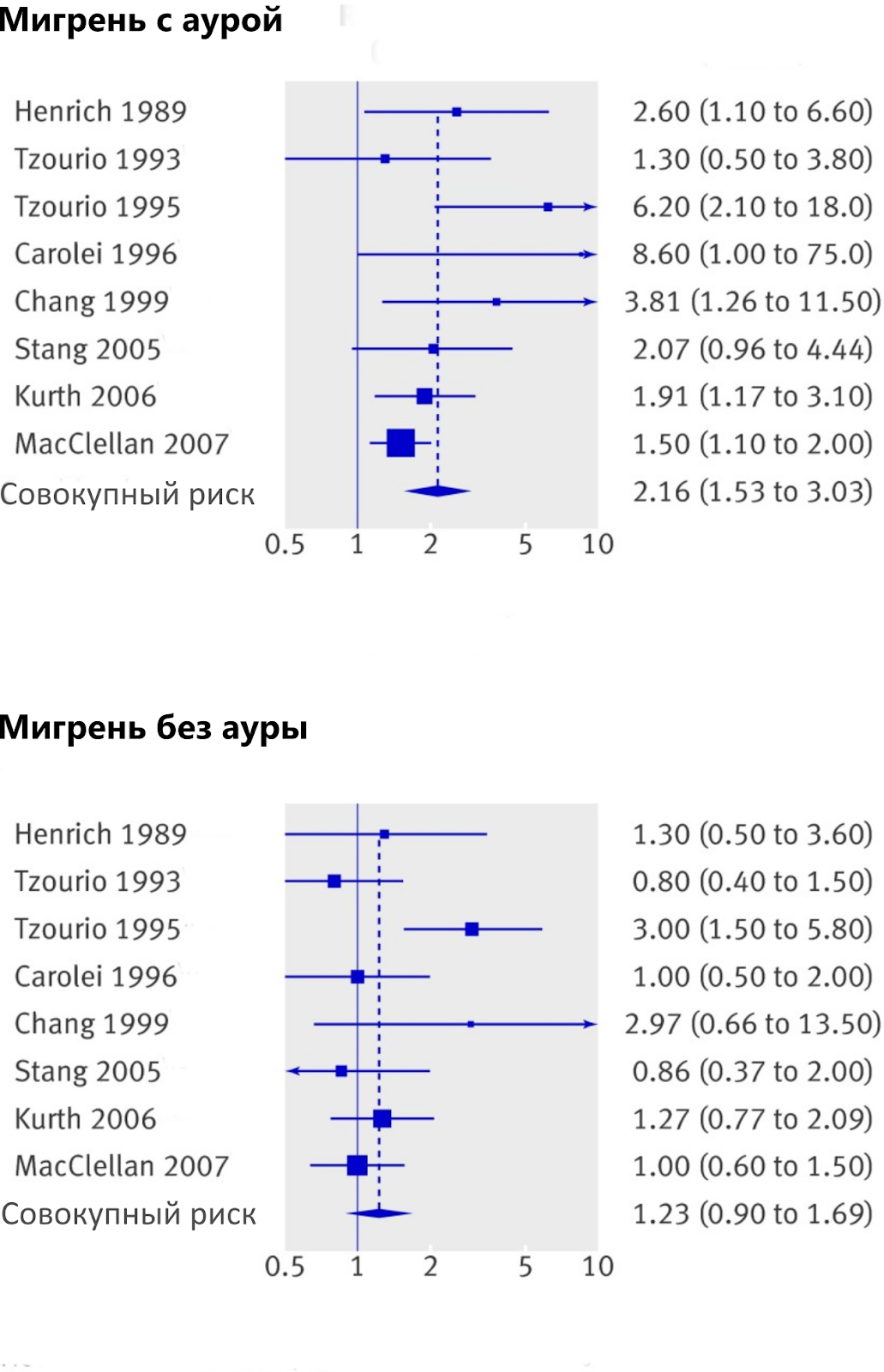
Рисунок 2. Связь мигрени с аурой и без ауры с развитием
Провокаторы приступа мигрени
По данным обзора доказательных данных, стресс, менструация, зрительные стимулы, изменения погоды, нитраты, голод и употребление вина являются вероятными провокаторами приступов мигрени, а нарушения сна и аспартат — возможными (Martin VT, Behbehani MM. 2001). Все возможные и вероятные триггеры, за исключением аспартата, были общими общими для всех типов головной боли. ПОлучены данные о том, что глутамат натрия является общим триггером для головной боли, но его роль в качестве триггера мигрени не доказана. В отношении курения, запахов, шоколада, пищи, содержащей тирамин не получено доказательств роли в провокации мигрени и других типов головной боли.
Пища:
- алкогольные напитки (красное вино, пиво, виски, шампанское);
- зрелые сыры;
- подсластители;
- кофеин (чрезмерное количество или резкое прекращение использования);
- луковые овощи (лук репчатый, лук зеленый свежий, лук-батун, лук-шалот, многоярусный лук, лук-порей, чеснок);
- мясные консервы и колбасные изделия;
- орехи;
- пищевые добавки (нитриты, нитраты, глутамат-натрия, аспартат);
- солёная пища;
- сушёная рыба;
- сушёные фрукты;
- цитрусовые фрукты;
- шоколад.
Другие «триггеры»:
- обезвоживание;
- депрессия;
- физическая нагрузка (чрезмерная);
- переутомление;
- напряжение глаз;
- световые раздражители (вспышки, солнечный свет, особенно ослепительный);
- менструальный период;
- лекарственные препараты (нитроглицерин, курантил);
- шум;
- резкие запахи;
- сон больше или меньше обычного;
- пропуск приёма пищи;
- стресс;
- просмотр телевизора;
- изменение погоды.
Клиника
Мигрень проявляется повторными приступами. Приступы — это череда событий, последовательно сменяющих друг друга на протяжении промежутка от нескольких часов до нескольких дней. Типичный приступ мигрени развивается, проходя четыре фазы: продром, аура, головная боль и постдром.
Продром мигрени — продромы отмечают у себя до 77% пациентов, страдающих мигренью, они включают в себя аффективные или вегетативные симптомы, развиваются за 24–48 часов до приступа головной боли. Наиболее частыми продромальными симптомами являются учащённое зевание, эйфория, депрессия, раздражительность, тяга к определённому типу пищи, запоры и ощущение скованности в шее.
Аура мигрени — около 25% страдающих мигренью, описывают у себя один или более неврологических симптомов во вторую фазу приступа, которая называется «аура мигрени». Традиционно считается, что аура мигрени обычно предшествует головной боли. Однако, данные проспективных исследований указывают, что у большинства пациентов головная боль возникает в фазу ауры (Hansen J. M. Lipton R. B. 2012).
Типичная аура мигрени характеризуется постепенным развитием, продолжительностью не более одного часа, сочетанием позитивных и негативных симптомов и полной обратимостью. Положительные симптомы (»симптомы раздражения») являются следствием выделения медиаторов нейронами центральной нервной системы. Типичными положительными симптомами являются зрительные (например, яркие линии, очертания, объекты), слуховые (например, шум или звон в ушах, ощущение музыки), соматосенсорные (например, жжение, боль, парестезия), или моторные (например, подёргивания или ритмичные повторные движения). Негативные симптомы указывают на выпадение или снижение функции, к ним относятся снижение остроты зрения, слуха и нарушения других видов чувствительности, способности к движениям отдельных частей тела. Наиболее часто у пациентов развивается зрительная аура, но могут быть сенсорные, речевые и двигательные нарушения.
Аура мигрени обычно постепенно развивается в течение более пяти недель. Реже отмечается более быстрое развитие ауры (менее, чем в течение 5-ти минут). Острое развитие ауры, делает её симптомы более похожими на признаки инсульта или транзиторной ишемической атаки (ТИА). В одной серии наблюдений, у четырёх пациентов (2%) отмечалось острое развитие чисто зрительной ауры [81].
Зрительная аура — классическим началом зрительной ауры считается появление небольшой области выпадения зрения, обычно кнаружи от середины поля зрения. Она может выглядеть как яркое пятно или область выпадения зрения. В течение последующих пяти минут — часа, зрительные нарушения становятся более распространёнными, развивается квадрантная анопсия или гемианопсия. Кроме этого, перед глазами часто появляются геометрические фигуры или зигзагообразные линии. Очертания дали аурам одно из наиболее распространённых названий — «фортификационный спектр» по причине сходства очертаний изображений во время ауры с ломаными линиями периметра крепостных стен. Положительные зрительные феномены могут иметь серповидное или С-образное распространения в сторону периферии поля зрения, оставляя по ходу скотому или полное выпадение зрения. С перемещением симптомов ауры к периферии поля зрения, она часто становится переливающейся или мерцающей. При разрешении симптомов ауры, зрение как правило восстанавливается в центре области зрительных нарушений, возникших во время ауры (Cutrer FM, Huerter K. 2007).
Рисунок 3. Периметр Петропавловской крепости, очертание стен которой соответствует понятию «фортификационный спектр»
Сенсорная аура — также распространённый вид ауры, обычно развивается в течение нескольких минут после развития зрительной ауры, кроме того, она также может возникать без зрительной ауры. Сенсорная аура обычно возникает как ощущение покалывания в конечностях или в половине лица. В то время как ощущение покалывания может переходить с одной стороны на другую или распространяться на конечности, онемение сохраняется в том месте, где возникает и может сохраняться до одного часа. Симптомы сенсорной ауры также могут ограничиваться слизистой оболочкой полости рта, вовлекая внутреннюю поверхность щеки и половину языка. Медленное распространение положительных симптомов (мерцание или покалывание) сменяется негативными симптомами (скотома или онемение) достаточно характерно для ауры мигрени и не типично для ишемического поражения мозга.
Речевая аура — встречается значительно реже, чем зрительная и сенсорная ауры, представляет собой преходящие речевые нарушения. Речевая аура вызывает преходящие нарушения речи, выраженность которых находится в диапазоне от лёгких затруднений в подборе слов до отчётливой афазии с парафазиями.
Моторная аура — наиболее редкий вид ауры, моторная аура, сопровождается односторонней слабостью конечностей и, в некоторых случаях, лица. Ввиду того, что получены данные о генетической природе моторной ауры, она рассматривается отдельно от других форм ауры и классифицируется как «гемиплегическая мигрень». Симптомы ауры могут развиваться либо по отдельности, либо сменяя друг друга, но, как правило, не отмечаются одновременно.
Аура без головной боли — у некоторых пациентов может развиваться аура без сопутствующей головной боли. Аура мигрени без головной боли (также известная как, эквивалент мигрени или ацефалгическая мигрень) проявляется изолированно, без характерной головной боли. В датском исследовании с оценкой клинических наблюдений, у 38% пациентов возникали приступы ауры мигрени без головной боли, одновременно с аурами с последующим развитием головной боли, а у 4% возникали только ауры мигрени без последующего развития головной боли. Ауры без головной боли могут быть ошибочно приняты за транзиторные ишемические атаки, особенно, если впервые возникают у пожилых пациентов, сопровождая мигрень с поздним началом, которая описывается в следующем разделе.
Симптомы сопровождающие мигрень с поздним началом — симптомы, сопровождающие мигрень, возникающие у пациентов в возрасте старше 50 лет, аура мигрени без головной боли [83,84]. Наиболее частыми симптомами являются зрительная аура с последующим развитием сенсорной ауры (парестезии), речевые нарушения и моторные ауры (слабость или паралич). Чаще всего, симптомы ауры развиваются постепенно, неврологические нарушения отмечаются в течение нескольких минут, постепенно сменяясь нарушениями другой модальности.
Мигренозная головная боль — часто, но не всегда носит односторонний характер, пульсирующая, особенно при нарастании интенсивности. Во время приступа тяжесть головной боли нарастает в течение одного-нескольких часов, пациентов часто отмечается тошнота, иногда — рвота. Многие пациенты отмечают во время приступа свето — или звукобоязнь, что заставляет их в попытке облегчить симптомы, переносить приступ лёжа в тёмной тихой комнате. Во время приступов могут возникать и более редкие симптомы — боязнь запахов и кожная аллодиния.
У взрослых, при отсутствии лечения, продолжительность приступа может находится в промежутке от четырёх часов до нескольких дней. Многие приступы прекращаются если пациент засыпает.
Постдром мигрени — после прекращения пульсирующей головной боли, у пациента может возникать постдромальная фаза, во время которой резкие движения головой провоцируют возобновление боли в области, в которой она ранее отмечалась. Во время постдромальной фазы, пациенты часто чувствуют себя «выжатыми» и истощёнными, однако, некоторые сообщают о лёгкой приподнятости и эйфории.
Осложнения мигрени
Осложнения мигрени характеризуются сочетанием приступов со стойкими симптомами, или, реже, развитием инфаркта мозга или эпилептических припадков.
Стойкие симптомы могут отмечаться только во время головной боли, продолжаться несколько дней или недель, а в ряде случаев — вызывать стойкий неврологический дефицит.
Мигренозный статус — приступ изнуряющей мигренозной боли, продолжающийся более 72 часов.
Персистирующая аура без инфаркта — симптомы ауры, сохраняющиеся в течение недели и более без признаков острого инфаркта по данным нейровизуализации.
Мигренозный инфаркт — приступ мигрени у пациента страдающего мигренью с аурой, при котором один или более симптомов сохраняются в течение часа и более, а данные нейровизуализации выявляются инфаркт в области мозга, отвечающей за развитие нарушений.
Эпилептический припадок, спровоцированный аурой мигрени — возникает у пациентов, страдающих мигренью с аурой, во время приступа или спустя не более чем час после приступа мигрени с аурой.
Диагностика
Диагноз «мигрень» устанавливается в соответствии с критериями, включающими клинические характеристики головной боли: частоту, интенсивность, продолжительность, сопутствующие симптомы и влияние на активность.
Критерии диагностики МКГБ-3
Мигрень без ауры
- Не менее 5 приступов, соответствующих критериям B-D, приступы головной боли продолжающиеся 4–72 часов, (без лечения или, если лечение неэффективно).
- Головная боль соответствует не менее чем двум из четырёх ниже описанных определений:
- односторонняя локализация;
- пульсирующий характеристик;
- умеренная или выраженная интенсивность боли;
- боль усиливается при рутинной физической активности или ограничивает активность (например, ходьба или подъём по лестнице).
- Во время головной боли отмечается одно из следующих условий:
- нет тошноты и рвоты;
- свето — и звукобоязнь.
- Случай не имеет лучшего объяснения диагнозом другого состояния из МКГБ-3.
Мигрень с аурой
- Не менее двух приступов, соответствующих критериям В и C.
- Один и более из нижеперечисленных полностью обратимых симптомов ауры:
- зрительные нарушения;
- чувствительные нарушения;
- речевые нарушения;
- двигательные нарушения;
- стволовые нарушения;
- нарушения со стороны сетчатки (ретинальные).
- Не менее трёх из следующих характеристик:
- не менее одного симптома ауры, выраженность которого постепенно усиливается на протяжении >5 минут;
- во время последовательно возникает не менее двух симптомов ауры;
- каждый отдельный симптом ауры продолжается 5–60 минут;
- как минимум, один симптом ауры односторонний;
- как минимум, один симптом ауры положительный;
- аура сопровождается головной болью или головная боль развивается в течение 60 минут после развития ауры.
- Состояние не имеет лучшего объяснения другим диагнозом из МКГБ-3.
Хроническая мигрень
Описание: головная боль возникающая 15 и более дней в месяц на протяжении более трёх месяцев, в это время не менее восьми дней в месяц, головная боль имеет признаки мигренозной.
A. Головная боль (сходная с мигренью или головной болью напряжения) в течение >15 дней в месяц >3 месяцев, и соответствующая критериям В и C.
B. Возникает у пациента, у которого было не менее пяти приступов, соответствующих критериям В D для 1.1 мигрени без ауры и/или критериям В и C для 1.2 мигрень с аурой.
C. >8 дней в месяц >3 месяцев, верно любое из нижеследующих утверждений:
- критерии C и D для мигрени без ауры;
- критерии В и C для мигрени с аурой;
- случай в начале рассматривается пациентом как мигрень и купируется триптаном или производными алкалоидов спорыньи.
D. Случай не имеет лучшего объяснения другим диагнозом МКГБ-3.3–5.
Лечение
Купирование приступа
- Нестероидные противовоспалительные препараты (НПВС): аспирин, ибупрофен, напроксен и диклофенак.
- Триптаны: суматриптан, ризатриптан, элетриптан, алмотриптан, золмитриптан, наратриптан и фроватриптан.
- Комбинация суматриптана и напроксена.
- Противорвотные/антагонисты дофаминовых рецепторов: хлорпромазин (Аминазин) и метоклопрамид (церукал).
Для лечения приступов лёгкой и средней тяжести без сопутствующей рвоты или выраженной тошноты у взрослых для первоначального лечения использование простых обезболивающих препаратов, включая НПВС или парацетамол, предпочтительнее, чем назначение других препаратов для купирования приступа мигрени (уровень доказательности 2C).
Для лечения приступов умеренной или высокой тяжести у амбулаторных пациентов использование триптана или комбинации суматриптан-напроксен предпочтительнее, чем назначение других препаратов для купирования приступа мигрени (уровень доказательности 2C). К настоящему времени данных в пользу преимущества одного триптана над другим не получено; выбор препарата основывается на различных фармакологических свойствах и предпочтительном способе введения препарата. В случае неэффективности одного триптана, другой триптан может быть эффективным.
Медикаментозное купирование приступа мигрени обычно более эффективно в случае раннего приёма препарата; однократный приём лекарства в большой дозе, предположительно более эффективен, чем повторный приём меньших доз препарата. Особенно это важно для триптанов, которые следует принимать при появлении первых признаков боли у пациентов, чувствительных к аллодинии кожи.
Многие пероральные препараты неэффективны ввиду плохого всасывания в связи с тем, что мигрень вызывает гастростаз. Поэтому, пациентам, у которых приступ мигрени сопровождается выраженной тошнотой или рвотой предпочтительно использовать пути введения отличные от перорального.
Пациентам, которые поступают в стационар с головной болью умеренной или высокой тяжести, особенно, если мигрень сопровождается рвотой или выраженной тошнотой, предлагается начало лечения с парентерального введения противорвотного препарата или, при доступности, подкожной лекарственной формы суматриптана, предпочтительнее, чем назначение других препаратов для купирования приступа мигрени (уровень доказательности 2C); рациональным выбором является метоклопрамид (10 мг). По совокупным данным двух рандомизированных исследований, назначение метоклопрамида устраняет головную боль лучше, чем плацебо (ОШ 2,84; 95% ДИ 1,05–7,68).
При введении метоклопрамида для лечения мигрени, целесообразно дополнительное введение дифенгидрамина — димедрола (12,5 — 20 мг внутривенно до двух доз с интервалом в один) для профилактики акатизии и других дистонических реакций (уровень доказательности 2C).
Более агрессивным альтернативным подходом, основанным на результатах одного клинического исследования, является введение метоклопрамида в высокой дозе (20 мг внутривенно каждые 30 минут до четырёх доз) вместе с дифенгидрамином (Colman I, Brown MD, Innes GD, 2004 ).
Использование антисеротонинергических препаратов — ондансетрона и гранисетрона в лечении острого приступа мигрени ограничивается частым развитием головной боли при введении препаратов.
Внутривенное введение дигидроэрготамина (DHE 45) 1 мг с внутривенным введением метоклопрамида 10 мг также является разумной альтернативой лечения тяжёлой мигрени резистентной к терапии, и может использоваться, если монотерапия метоклопрамидом неэффективна. Парентеральное введение DHE 45 не должно использоваться как монотерапия. DHE 45 противопоказан пациентам с ишемическими сосудистыми заболеваниями, включая сердечно-сосудистые, цереброваскулярные и заболевания соединительных артерий.
Пациентам, получающим лечение в отделении неотложной помощи при помощи одного из видов стандартной терапии, описанных выше, рекомендуется дополнительное внутримышечное введение дексаметазона (10–25 мг) для снижения риска раннего рецидива головной боли (уровень доказательности 1B).
Подъязычные, пероральные или ректальные лекарственные формы эрготамина являются препаратами выбора у относительно небольшого количества пациентов, страдающих мигренью ввиду непредсказуемой эффективности и риска развития серьёзных нежелательных явлений. Подходящими кандидатами могут быть лица с большой продолжительностью приступов (более 48 часов) и высокой частотой рецидивов головной боли.
Профилактическое лечение мигрени показано, если пациенты страдают от частых длительных головных болей, или если головная боль вызывает выраженные функциональные нарушения и снижает качество жизни. Кроме того, профилактическое лечение мигрени рекомендуется для снижения риска развития неврологических нарушенийу пацинетов с редкими формами мигрени, включая гемиплегическую мигрень, мигрень со стволовой аурой и мигрень с длительной аурой.
Всем пациентам с мигренью рекомендуются немедикаментозные меры профилактики: соблюдение рекомендаций по гигиене сна, регулярный приём пищи, регулярные физические упражнения и устранение триггеров мигрени.
Профилактическое лечение мигрени
Пациентам, страдающим мигренью, у которых есть показания для профилактического лечения, рекомендуется назначение одного из препаратов, эффективность которого доказана контролируемыми исследованиями (уровень доказательности 2A), к которым относятся следующие средства:
Бета-блокаторы
- Метопролол (Беталок-ЗОК) 25 — 100 мг х 2 раза в день.
- Пропроналол (Анаприлин) 20 — 80 мг х 2 раза в день.
Антидепрессанты
- Амитриптилин 10–50 мг х 1 раз в день (на ночь).
- Венлафаксин 37,5 — 150 мг х 1 раз в день (утром).
Противоэпилептические препараты
- Вальпроаты 250 — 750 мг х 2 раза в день (ограничено использование высоких доз, назначение детям и женщинам детородного возраста).
- Топирамат 12,5 — 100 мг х 2 раза в день (доказана эффективность дозы ≥100 мг/сут).
Профилактическая эффективность Габапентина в дозе 1200–3000 мг/сут не доказана в рандомизированных исследованиях (Silberstein S, Goode-Sellers S, 2012).
Антагонисты кальция
Могут быть менее эффективны, но при этом более безопасны и лучше переносятся.
- Верапамил 40–80 мг х 3 раза в день.
Данные небольших исследований указывают на профилактическую эффективность ингибиторов АПФ — лизиноприла 10–20 мг/сут и блокатора ангиотензинового рецептора кандесартана 16 мг/сут.
Моноклональные антитела, антагонисты кальцитонин–ген связанного пептида: эренумаб (»Аймовиг» (Aimovig), фреманезумаб и галканезумаб. Основная разница между всеми молекулами состоит в том, что эренумаб связывается напрямую с рецептором КГСП, тогда как остальные имеют сродство к лигандам КГСП. Эренумаб вводится подкожно. В рандомизированных клинических исследованиях получены данные об эффективности препаратов. К их недостаткам относится высокая стоимость лечения и недостаточно изученная безопасность.
При неэффективности одного из выбранных лекарственных препаратов, предлагается начало лечения профилактическим препаратом из ДРУГОЙ ГРУППЫ (уровень доказательности 2C).
Профилактическое лечение мигрени требует постоянного взаимодействия пациента и врача для достижения эффекта.
Обычно, профилактические препараты назначаются в низкой дозе с постепенным повышением до достижения терапевтического эффекта, максимальной дозы или неприемлемых нежелательных явлений. Улучшение чаще всего отмечается в течение первых четырёх недель, его выраженность может усиливаться в течение 3-х месяцев.
Нефармакологические меры, эффективные при мигрени, включают аэробные нагрузки, биологическую обратную связь и другие формы релаксации, когнитивно-поведенческую терапию, акупунктуру и чрескожную электростимуляцию нервов.
Таблица 1. НПВС и парацетамол для лечения острого приступа мигрени (Becker W. J. 2015)
| Препарат | Tmax (часов) | T½ (часов) | NNT*: облегчение боли на 2 часа | NNT*: полное купирование боли на 2 часа | Доза (мг)* | Диапазон доз(при повторном приёме) и максимальная суточная доза* |
|---|---|---|---|---|---|---|
| Парацетамол | 0,5–1 | 2 | 5,0 | 12 | 1000 | Каждые 4 часа, максимально 4000 мг. |
| Аспирин (ацетилсалициловая кислота) (таблетки) | 1–2 | Аспирин: 0,25 ацетилсалициловая к-та (действующее в-во): 5–6 (после приёма дозы 1 г) | 4,9 | 8,1 | 975–1000 | Каждые 4–6 часов; максимально: 5.4 г/сут (в зависимости от показаний). |
| Аспирин (шипучие таблетки) | ~20 минут | см. выше | см. выше | см. выше | 975–1000 | Каждые 4 часа; максимально: 8 (325 мг) таблеток |
| Ибупрофен (таблетки) | 1–2 | 2 | 3,2 | 7,2 | 400 | Каждые 4 ч; максимально: 2400 мг |
| Напроксен натрия** | 2 | 14 | 6,0 | 11 | 500–550 (до 825 мг) | Два раза в день; максимально: 1375 мг |
| Диклофенак натрия (таблетки) | <1 | 2 | 6,2 | 8,9 | 50 | 3–4 раза в день; максимально: 150 мг |
| Диклофенак натрия (Вольтарен Рапид, порошок для приготовления раствора для приёма внутрь) | 15 мин | 2 | 5,1 | 7,4 | 50 | При приступе мигренозной боли рекомендуется однократный приём. |
* Для лечения острого приступа мигрени рекомендуется приём 1–2 доз препаратов.
** Всасывается более быстро, чем напроксен.
Tmax — время достижения максимальной концентрации в плазме крови.
T1/2 — время полувыведения.
NNT* — число больных, которое необходимо пролечить для получения одного благоприятного или предупреждения одного неблагоприятного исхода.
Купирование приступа мигрени у беременных
Для лечения приступа мигрени у беременных женщин используется Парацетамол 1000 мг по 1 таблетке до 3-х раз в день. При недостаточной эффективности препарата используются следующие комбинации препаратов:
«Первая линия»
- Парацетамол 650–1000 мг и метоклопрамид 10 мг.
- Парацетамол и кодеин 30 мг (в России доступен в продаже комбинированный препарат Дротаверин-Парацетамол-Кодеин — Юниспаз).
- Буталбитал-ацетаминофен-кофеин (Буталбитал не продаётся в России, данные о возможности использования других барбитуратов не доступны).
Чтобы избежать развития абузусной головной боли, использование буталбитала должно быть ограничено 4–5 днями в месяц, а кодеина не более чем 5 днями в месяц.
«Вторая линия»
Аспирин и НПВС — напроксен, ибупрофен и кеторолак (наиболее безопасные препараты для использования во втором триместре). При использовании в первом триместре, возможно умеренное повышение риска невынашивания и отдельных врождённых дефектов, однако, доказательные данные об этом недостаточно сильны.
В третьем триместре использование НПВС должно ограничиваться промежутком в 48 часов ввиду возможности закрытия артериального протока в пренатальном периоде, развития у новорожденного стойкой лёгочной гипертензии, маловодия, некротизирующего энтероколита, нарушения функции почек или почечной недостаточности, а также внутричерепного кровоизлияния.
«Третья линия»
Опиоиды (морфин, промедол, оксикодон) не должны использоваться постоянно, поскольку вызывают привыкание, могут способствовать развитию абузусной и хронической ежедневной головной боли. Препараты этой группы могут повысить риск развития тошноты/рвоты и запора, связанных с беременностью. Приём любых опиоидов сопровождается риском развития зависимости у матери и синдрома отмены у новорожденного. Данные о связи приёма опиоидов с риском нарушений развития у новорожденных ограничены.
Триптаны рассматриваются как альтернатива для лечения симптомов умеренной или тяжёлой тяжести у пациентов, которые не отвечают на лечение другими препаратами. Используется Суматриптан (100 мг внутрь, 4–6 мг подкожно, 5–25 мг интраназально). Препарат избирательно сужает сосуды головного мозга, но, теоретически может вызывать сужение сосудов матки и плаценты, оказывать утеротоническое действие.
В регистре использования суматриптана у беременных, содержащем данные о 600 женщинах, использовавших препарат (из них, 514 использовали препарат в первом триместре), который ведётся производителем препарата, не установлено повышения риска врождённых пороков развития или невынашивания. В систематическом обзоре исходов беременности при использовании триптанов в пренатальном периоде (2015,6 исследований, 4208 новорожденных), у женщин, принимавших триптаны, отмечалась сходная частота врождённых пороков развития, преждевременных родов и спонтанных абортов, как и женщин, страдавших мигренью, но не принимавших триптаны.
При сравнении группы, принимавшей триптаны, с контрольной группой, частота тяжёлых врождённых пороков развития и преждевременных родов была сходной, но спонтанные аборты отмечались чаще.