Наиболее значимым фактором риска поражения мелких сосудов головного мозга является артериальная гипертензия [23]. При дисциркуляторной энцефалопатии встречаются как первичные сосудистые, так и вторичные дегенеративные изменения вещества головного мозга.
Выделяют несколько видов патологических изменений вещества головного мозга, ассоциированных с хроническим ишемическим повреждением [2,29,42].
- постинфарктные очаги (»неполные» и «немые» инфаркты),
- лейкоареоз (диффузные изменения белого вещества головного мозга),
- множественные лакуны,
- расширенные периваскулярные пространства,
- Последствия кровоизлияний,
- Атрофия вещества головного мозга,
Атеросклероз поражает артерии эластического и крупные артерии мышечного типа. В большинстве случаев атеросклероз приводит к развитию острых нарушений мозгового кровообращения с быстрым развитием выраженных очаговых симптомов. В патогенезе хронических сосудистых заболеваний головного мозга основное значение имеет поражение микроциркуляторного русла. Оно образовано терминальными ветвями крупных артерий каротидного и вертебрально-базилярного бассейна, а также притоками церебральных вен. Артерии микроциркуляторного русла подвержены изменениями при резких перепадах артериального давления поскольку на этом уровне не образуются анастомозы.
Болезнь мелких сосудов или микроангиопатия может иметь различной этиологии:
- Дегенеративная: например, липогиалиноз (артериосклероз) с развитием лакунарных инфарктов;
- Наследственная: церебральная аутосомная доминантная артериопатия с лакунарными инфарктами (CADASIL);
- Митохондриальная: митохондриальная энцефалопатия, лактат-ацидоз с инсультоподобными эпизодами (MELAS);
- Болезни накопления: накопление амилоида при церебральном амилоидозе;
- Первичную или связанную с неуточнённой причиной (предполагаются иммунологические, воспалительные изменения, интоксикация).
В ряде случаев, нарушения микроциркуляции могут быть вызваны патологией со стороны системы крови, без поражения кровеносных сосудов. Истинная полицитемия, гемоглобинопатии или протеинопатии могут повышать вязкость крови, что приводит к сопротивлению кровотоку и агрегации форменных элементов, является причиной церебральной ишемии. В редких случаях возможно развитие микроэмболии. Важными дополнительными факторами могут быть нарушения обмена веществ, прежде всего, сахарный диабет и нарушение венозного оттока.
Нарушения ауторегуляции мозгового кровообращения являются как причиной, так и следствием поражения микрососудов, принимая участие в порочном круге патологических изменений.
Лейкоареоз — нейровизуализационный термин (снижение рентгеновской плотности на КТ головного мозга, повышение интенсивности сигнала по данным МРТ в Т2/FLAIR режимах), описывающий неспецифические изменения подкоркового белого вещества головного мозга. Выявляются двусторонние очаговые, иногда сливные изменения. В основе лейкоареоза лежит поражение мелких артерий и артериол вследствие липогиалиноза (также обозначается как артериосклероз) и микроатероматоза [11].
Факторами риска развития лейкоареоза являются возраст, повышенное артериальное давление и сахарный диабет [18]. Повышение внутрижелудочкового давления рассматривается в качестве дополнительного механизма развития лейкоареоза, оно приводит к нарушению микроциркуляции в прилегающих к желудочкам участках головного мозга. У пациентов с нормотензивной гидроцефалией отмечаются распространённые изменения подкоркового белого вещества [21].
Доказана связь распространенности диффузных изменений белого вещества головного мозга с выраженностью депрессии и когнитивных нарушений [9,43].
В препаратах головного мозга лейкоареоз часто сочетается с расширением периваскулярных (Вирхова-Робина) пространств — криблюрами (‘etát criblé’). Этот феномен связывают с повторными эпизодами ишемии и плазматического пропитывания участков ткани, окружающих микрососуды.
Липогиалиноз — дистрофический процесс, поражающий пенетрирующие артерии и артериолы диаметром до 200 мкм. Протекает под действием повышения артериального давления, гипергликемии, а также вследствие возрастных изменений. Повышение тканево-сосудистой проницаемости в субэндотелиальном пространстве сосуда приводит к поступлению туда белков плазмы и адсорбции их на изменённых волокнистых структурах соединительной ткани с последующей преципитацией и образованием белка гиалина. В последующем, гиалин оттесняет и разрушает эластичную мембрану, средняя оболочка истончается, и перфорирующая артерия приобретает вид стекловидной трубочки. Просвет артерии резко сужается, возможно развитие окклюзии.
При развитии липогиалиноза фоне сахарного диабета субэндотелиально часто откладывается не только гиалин, но и липиды. Сосудистая стенка инфильтрируется макрофагами с включениям фагоцитированных липидов — пенистыми клетками. В изменённых тканях происходит отложение фибриноида (сложного вещества, состоящего из белков и полисахаридов, распадающихся коллагеновых волокон, межклеточного вещества и плазмы крови). В неблагоприятных условиях происходит гибель окружающих тканей — фибриноидный некроз. Этот патологических процесс выявляется в артериолах и капиллярах головного мозга, сетчатки и почек часто сочетается с гиалинозом.
Этот патологический процесс, видимо является реактивным феноменом. Он не рассматривается, как ведущая причина гипертонического внутричерепного кровоизлияния, так как в препаратах головного мозга в случаях острого внутричерепного кровоизлияния не обнаруживается на отдалении от гематомы. В лабораторных исследованиях выраженные изменения по типу фибриноидного некроза выявлялись вокруг стереотаксически введенных тромбов в опытах у грызунов, что могло указывать на его реактивное происхождение.
Вследствие нарушения работы ассоциации эндотелиоцит-глиальная клетка (астроцит)-нейрон (»нейроваскулярное звено«) страдают механизмы ауторегуляции мозгового кровотока на уровне капилляров и микроартериол. Это приводит к сужению диапазона допустимых показателей перфузии. Из-за того, что мелкие сосуды утрачивают способность расширяться, становится невозможным перераспределение кровотока в пользу активно работающих отделов мозга, а это в свою очередь приводит к их функциональной инактивации, а затем – и к необратимому повреждению. Преимущественное поражение белого вещества в перивентрикулярном и глубинных отделах при церебральной гипоперфузии объясняется особым характером их кровоснабжения сосудами терминального типа, не имеющими коллатералей.
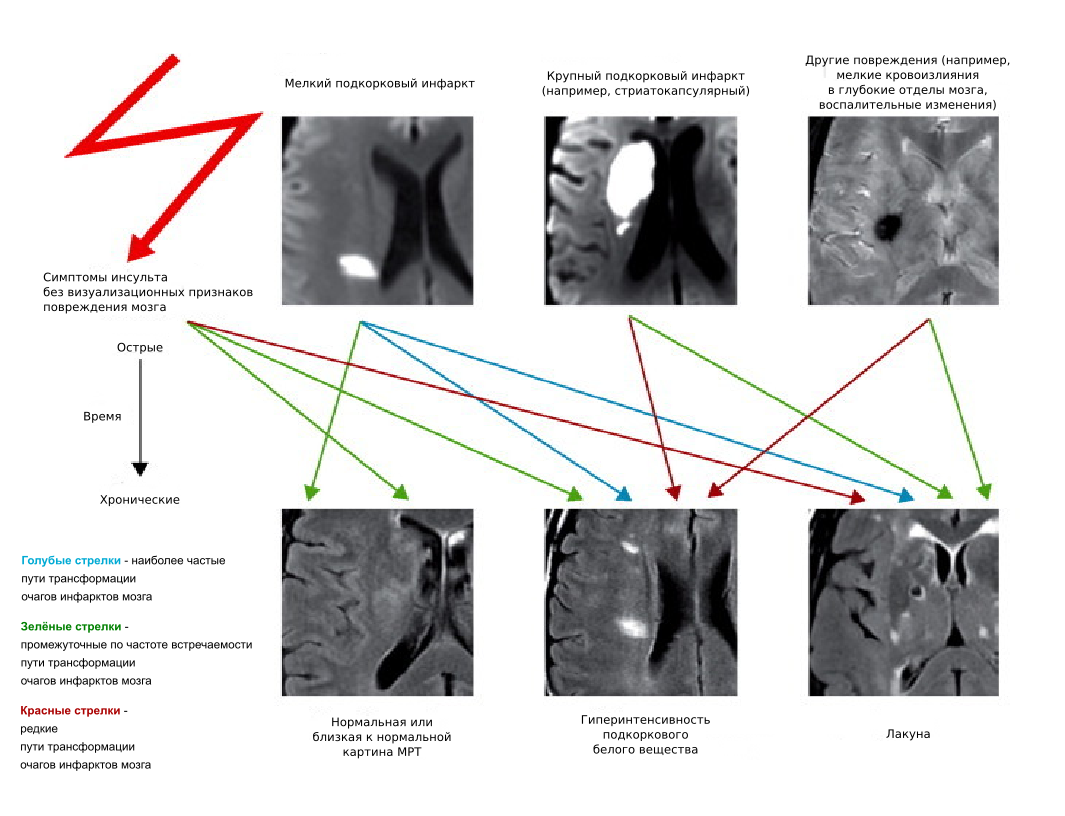
Клетки нервной ткани различаются по чувствительности к ишемии. При нарушении кровотока, некротические изменения развиваются сначала в нейронах, затем олигодендроцитах, миелинизированных аксонах, астроцитах и наконец в эндотелиальных клетках [38]. После гибели наиболее чувствительных типов клеток — нейронов и олигодендроцитов, относительно резистентные к ишемии астроциты, выполняющие в головном мозге опорную функцию, замещают дефект за счёт увеличения в объёме своих отростков. Формируется глиальный рубец (»неполный» инфаркт») [33]. При тотальной гибели всех элементов участка мозговой ткани формируется участок некроза (лакуна), на периферии регенерация глиальных клеток формирует его «оболочку».
В патологоанатомических исследованиях отмечена связь липогиалиноза мелких артерий с лакунарными инфарктами головного мозга. Указывается на более высокую распространённость расширенных периваскулярных пространств у пациентов с сосудистой деменцией, чем у пациентов с болезнью Альцгеймера [30]. У здоровых пожилых пациентов с выявленными расширенными периваскулярными пространствами отмечались худшие результаты тестирования когнитивных функций.
Микроатероматоз — атеросклеротическое поражение артериол, приводит к развитию более крупных лакунарных инфарктов. В зависимости от локализации, инфаркты могут проявляться клиникой инсульта, но чаще (примерно в 80 % случаев) протекают субклинически (»немые» инфаркты)[40]. У части пациентов основные патологические процессы вызываются церебральной амилоидной ангиопатией (ЦАА) — отложением амилоидных пептидов (прежде всего Аβ — амилоида) в мышечной оболочке и адвентиции микрососудов и сосудов среднего калибра, значительно реже в стенках капилляров и вен.
Частота выявления амилоидоза церебральных артерий на аутопсии с возрастом увеличивается: на основании серии из 784 аутопсийных материалов, признаки умеренной и тяжёлой ЦАА встречались с частотой 2.3% в возрасте от 65 до 74 лет, 8.0% в возрасте от 75 до 84 лет, и 12.1% в возрасте старше 85 лет [14].
Значимых половых различий во встречаемости амилоидоза не выявлено. Несмотря на то, что вопрос связи ЦАА с артериальной гипертензией продолжает обсуждаться, очевидно, что в большом количестве случаев у пациентов при жизни отмечалось нормальное артериальное давление[3].
Рисунок 1. Пути трансформации мелких сосудистых очагов и сходство МРТ картины отдалённых последствий поражения мозга различной природы
Предполагается, что амилоидные пептиды, блокируют отток по переваскулярным пространствам, выполняющим в головном мозге дренажную функцию. Повышение ломкости стенки сосудов при отложении амилоида значительно увеличивает риск внутримозговых кровоизлияний. Они, как правило, имеют небольшие размеры и располагаются кнаружи от внутренней капсулы, в белом веществе больших полушарий, для сравнения, гипертонические кровоизлияния поражают преимущественно область подкорковых ядер. В связи с таким расположением микрокровоизлияний при ЦАА, подкорковые структуры остаются относительно интактными, поэтому, экстрапирамидные симптомы не характерны для клиники этого состояния. По данным Фрамингемского исследования установлена связь деменции и внутримозговых микрокровоизлияний, которая не зависела от выраженности других сердечно-сосудистых факторов риска. Наличие ЦАА предполагается у пациентов старше 55–60 лет с множественными лобарными кровоизлияниями без другой явной причины.
Бостонские критерии для кровоизлияний, связанных с церебральной амилоидной ангиопатией [19]
- Достоверный случай
- По результатам полного посмертного патологоанатомического исследование выявлены:
- Лобарные, кортикальные и субкортикальные кровоизлияния.
- Выраженные признаки ЦАА с поражением сосудов.
- Нет указаний на другие заболевания, объясняющие результаты исследования.
- По результатам полного посмертного патологоанатомического исследование выявлены:
- Вероятный случай ЦАА, с патологанатомическим подтверждением
- Клинические данные и патологоанатомическое исследование образца ткани (эвакуированная гематома или биоптат участка коры головного мозга) указывают на:
- Лобарные, кортикальные и субкортикальные кровоизлияния.
- Отдельные признаки ЦАА с поражением сосудов.
- Нет указаний на другие заболевания, объясняющие результаты исследования.
- Клинические данные и патологоанатомическое исследование образца ткани (эвакуированная гематома или биоптат участка коры головного мозга) указывают на:
- Вероятный случай ЦАА
- Клинические данные, результаты КТ и/или МРТ:
- Множественные лобарные, кортикальные и субкортикальные кровоизлияния (допускается наличие кровоизлияний в мозжечок)
- Возраст ≥55 лет.
- Нет указаний на другие причины кровоизлияний*
- Клинические данные, результаты КТ и/или МРТ:
- Возможный случай ЦАА
- Клинические данные, результаты КТ и/или МРТ:
- Множественные лобарные, кортикальные и субкортикальные кровоизлияния (допускается наличие кровоизлияний в мозжечок)
- Возраст ≥55 лет
- Нет указаний на другие причины кровоизлияний*
- Клинические данные, результаты КТ и/или МРТ:
*приём варфарина с превышением целевого значения МНО (> 3,0), перенесённые инсульты и черепно-мозговые травмы, опухоли головного мозга, сосудистые аномалии и васкулиты, патология системы крови, коагулопатии [41].
У пациентов с подозрением на церебральную амилоидную ангиопатию, развитие острых и транзиторных неврологических нарушений может быть связано с геморрагическими осложнениями, что стоит принимать во внимание при планировании их обследования.
У пациентов с выраженным лейкоареозом и множественными лакунарными инфарктами в отсутствии факторов риска сосудистых заболеваний стоит предположить наличие церебральной аутосомно-доминантной артериопатии с подкорковыми инфарктами и лейкоэнцефалопатией (CADASIL) — наследственного заболевания, вызванного мутацией гена Notch 3 на 19-й хромосоме. У трети пациентов, страдающих этим заболеванием, отмечается мигрень с аурой, которая рассматривается как раннее проявление заболевания. Приблизительно у 75% лиц, носителей мутации, в конечном счёте развивается деменция[27].
Таким образом, хронические сосудистые поражения головного мозга определяются большим количеством факторов риска, как генетических, так и средовых. Профиль факторов риска развития дисциркуляторной энцефалопатии и инсульта не тождественны. Поражение артерий мозга может быть и изолированным — встречается у пациентов без поражения прецеребральных артерий и артериальной гипертензии.
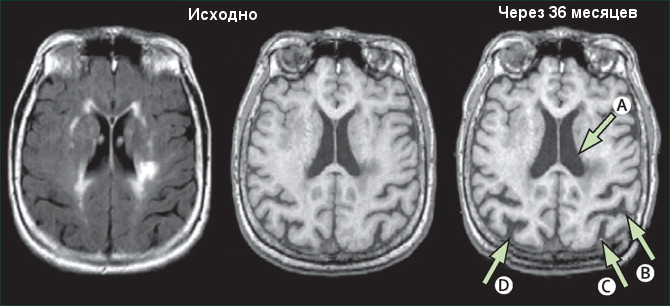
Рисунок 2. Динамика атрофических изменений вещества головного мозга
В патогенезе развития основных симптомов дисциркуляторной энцефалопатии (когнитивных нарушений, нарушений ходьбы, пирамидных и мозжечковых знаков, псевдобульбарного синдрома) лежит разобщение корковых и подкорковых структур вследствие поражения подкоркового белого вещества больших полушарий. Нарушается работа корково-подкорковых кругов, обеспечивающих последовательную избирательную активизацию отдельных участков коры головного мозга при выполнении сложных многоэтапных действий, поддерживающих общий уровень активности коры, несущих информацию для коррекции действий на стадии афферентного синтеза и исполнения (функции I [энергетического] и III [программирование, регуляция и контроль] блоков по А. Р. Лурия).
Клинико-нейровизуализационные соответствия
Термин «энцефалопатия» предполагает наличие не только субъективных жалоб, но и объективных признаков органического поражения мозга, выявляемых при неврологическом или нейропсихологическом исследовании [2]. Вместе с тем, обнаружение подобных признаков, даже вкупе с сосудистыми факторами риска, клиническими или параклиническими признаками цереброваскулярной патологии является необходимым, но недостаточным признаком ДЭП. Важнейшим принципом диагностики ДЭП должна стать констатация причинно-следственной связи между имеющимися у больного клиническими проявлениями и цереброваскулярным заболеванием.
Подобный принцип впервые был заложен в критерии клинической диагностики сосудистой деменции NINDS-AIREN. Представляется, что только следование этому принципу позволит избежать гипердиагностики ДЭП и отделить случаи ДЭП от нейродегенеративных заболеваний, широко представленных у лиц пожилого возраста (в первую очередь от болезни Альцгеймера или болезни Паркинсона, набор симптомов которых на начальных стадиях может соответствовать последствиям хронического сосудистого поражения головного мозга).
Доказательством причинно-следственной связи могут служить:
- характеристики отдельных симптомов (нейродинамический или дизрегуляторный характер когнитивного дефекта, сочетание когнитивных с аффективными нарушениями, а также неврологическими нарушениями, свидетельствующими о вовлечении глубинных отделов мозга, в том числе дизартрией, экстрапирамидными знаками, нарушением ходьбы/постуральной устойчивости и др. ),
- течение заболевания со ступенеобразным прогрессированием нарушений,
- соответствие клинической картины данным дополнительных методов исследования, в первую очередь компьютерной томографии (КТ) или магнитно-резонансной томографии (МРТ) головного мозга,
- отсутствие клинических или параклинических признаков другого заболевания, которое может объяснить клиническую картину.
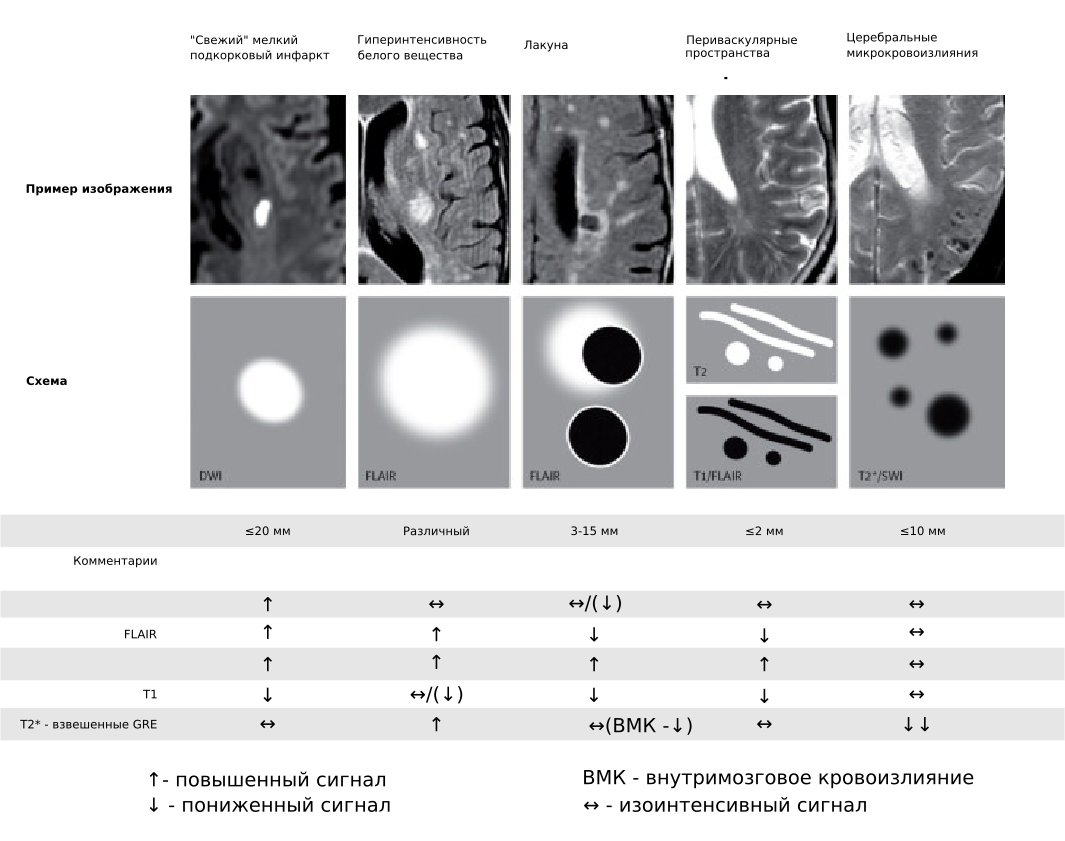
КТ или МРТ головного мозга при ДЭП могут выявить: двустороннее более или менее симметричное диффузное поражение белого вещества (лейкоареоз) в перивентрикулярной зоне, зрительной лучистости, семиовальном центре; множественные лакунарные очаги (размером 3–15 мм) в базальных ганглиях, таламусе, мосте, мозжечке, внутренней капсуле, белом веществе лобных долей; более крупные корковые и подкорковые инфаркты, отражающие патологию крупных артерий. Церебральная атрофия, выявляемая при КТ или МРТ у больных ДЭП, обычно сопровождает лейкоареоз, лакунарые или территориальные инфаркты [2]. Как правило, расширение желудочковой системы при ДЭП более выражено, чем расширение корковых борозд, и может отражать не только убыль мозгового вещества в глубинных отделах мозга, но и, возможно, снижение резистентности перивентрикулярных тканей к ликвородинамическим воздействиям [2].
В ряде исследований выявлена связь между тяжестью и/или локализацией нейровизуализационных изменений и выраженностью когнитивных и двигательных нарушений [18]. Так, показано, что умеренное когнитивное расстройство возникает, когда распространенность лейкоареоза превышает как минимум 10% белого вещества полушарий, а деменция – если распространенность лейкоареоза превысит 1/4 объема белого вещества полушарий. При наличии лакун выраженность когнитивных нарушений зависит не столько от числа лакунарных очагов, сколько от их локализации (глубинные отделы лобных долей, головка хвостатого ядра и переднее бедро внутренней капсулы, таламус). Выраженность когнитивных нарушений увеличивается при двустороннем поражении указанных структур и сочетании лакунарных очагов с лейкоареозом. Более того, должно быть соответствие между нейровизуализационными изменениями и профилем когнитивных нарушений. Например, в отсутствие соответствующих корковых очагов на КТ и МРТ у пациентов не должны выявляться признаки очагового поражения корковых функций: афазии, апраксии и агнозии. Отмечена также связь между распространенностью лейкоареоза, особенно в передних отделах мозга, локализацией лакунарных очагов в чечевицеобразном ядре и выраженностью нарушений ходьбы и равновесия.
Выраженность когнитивных и двигательных нарушений при ДЭП коррелирует и со степенью расширения боковых желудочков и особенно их передних рогов. С другой стороны, отсутствие сосудистых изменений на МРТ при клинической картине I-III стадий ДЭП и КТ при клинической картине II – III стадий ДЭП может заставлять усомниться в диагнозе. Данные КТ и МРТ имеют значение не только в диагностике ДЭП, но и могут помочь отслеживать динамику заболевания, быть маркером эффективности мер по коррекции факторов риска сердечно-сосудистых осложнений [2]. Отдельные нейровизуализационные феномены считаются нормальным проявлением старения: [12,42]
- Лёгкое или умеренное снижение объёма мозговой ткани:
- Увеличение желудочков
- Расширение третьего желудочка
- Расширение борозд головного мозга, прежде всего за счёт истончения коры.
- Одинаковая выраженность изменений лобных и теменных долей.
- Лёгкая атрофия медиальных отделов височной доли.
- Полости в гиппокампальной борозде.
- Увеличенные периваскулярные пространства Вирхова–Робина:
- область подкорковых ядер, около передней спайки,
- белое вещество семиовального центра (подкоркового белого вещества), в верхней части
- средний мозг.
- Изменения в сосудистой стенке:
- удлинение и патологическая извитость артерий (например, базилярная артерия),
- истончение стенки и кальцификация (например, сифона сонной артерии).
- Изменения в мозговой ткани:
- точечные или сливные изменения подкоркового белого вещества,
- лакунарные инфаркты и/или микрокровоизлияния (при отсутствии клинической картины, как случайные находки при проведении нейровизуализации),
- накопление железа в бледном шаре, скорлупе, зубчатом ядре.
Рисунок 3. Признаки поражения мозга, вызванного патологией мелких сосудов, по данным МРТ